发表期刊:Carbohydrate Polymers
影响因子:10.723
作者单位:遵义医科大学
百趣提供服务:16S测序
研究背景
流行病学研究表明,全世界约有5亿过敏性鼻炎(Allergic rhinitis, AR)患者,每年呈增长趋势。AR虽不会危及生命,但是其临床症状引起的情绪问题和间接经济损害不容忽视。在AR病理学研究中,发现Th1/Th2失衡以及异常高的免疫球蛋白E(immunoglobulin E, IgE)和肥大细胞表达水平是AR的重要致病因素。NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)炎性小体作为先天免疫的重要组成部分,在机体的免疫反应和疾病发生中起着至关重要的作用。其和IL-1β的过表达都存在于AR中,IL-1β促进Th0向Th17细胞分化,释放IL-17和其他相关细胞因子,从而促进过敏反应。而肠道微生物群的不平衡可诱发过敏反应,增加IgE的产生,也最终导致AR。
目前治疗AR的临床药物只能缓解症状,长期使用可能会引起嗜睡等副作用。因此,重要的是开发更好的AR治疗方法,减少不良反应。益生元可以调节肠道菌群失衡,修复肠道机械屏障,改善AR。而多糖除了是益生元外,还具有广泛的药理活性,例如抗炎、免疫调节等。
本研究以一种新的水提金银花多糖(Water-extracted Lonicera japonica polysaccharide, WLJP)为研究对象,按每组8只小鼠,分为对照组(给予生理盐水)、AR组(给予卵清蛋白(ovalbumin, OVA))、WLJP-L组(30mg/kg WLJP-0.25p)和WLJP-H组(60mg/kg WLJP-0.25p)。除对照组外,其余三组分别在0、3、6、9、12、15天进行致敏处理;在21-30天,对WLJP-L组和WLJP-H组进行灌胃给药,对照组及AR组给予生理盐水。于第31天将小鼠置于观察笼中,观察并记录小鼠在10分钟内的喷嚏和摩擦次数(图1A)。随后,麻醉小鼠,收集鼻粘膜、结肠组织和眼静脉丛,以获得血液和组织样本。进一步进行细胞因子检测、鼻腔组织的病理学评价、免疫荧光检测、流式细胞术分析、蛋白质印迹法(western blot, WB)分析、16S rDNA测序、分子对接和动力学模拟,以研究其对AR的免疫调节作用及其作用机制。
研究结果
1.WLJP-025p的提取、分离及化学性质分析
按照蒸馏水提取、乙醇沉淀冻干的流程来制备WLJP(5.1%),高效凝胶渗透色谱分析表明WLJP-025p是一个均匀的多糖组分。然后采用柱前衍生化高效液相色谱测定其糖成分,显示其为一种具有中性糖侧链的富含HG结构域的果胶多糖。最后通过核磁共振实验得出其主要结构性质。
2.WLJP改善OVA诱发的过敏性鼻炎
在摩擦和打喷嚏评估(图1B)中,在AR组有显著增加,而WLJP-L和WLJP-H组显著改善。AR组的血清IgE水平明显高于对照组,WLJP治疗显著降低了IgE浓度(图1C)。在图1D中,苏木精—伊红染色法(hematoxylin and eosin, H&E)染色显示AR组的表皮明显增厚,WLJP治疗显著抑制表皮厚度。在过碘酸-雪夫染色(periodic acid Schiff, PAS)中(图1E),对照组的鼻粘膜中未发现杯状细胞,而AR组观察到大量杯状细胞,WLJP-H组杯状细胞表达减少。
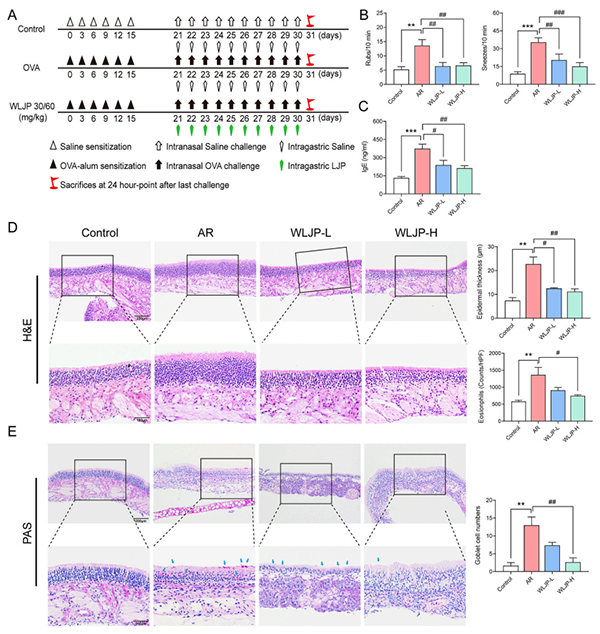
图1. WLJP改善OVA诱发的过敏性鼻炎
3.WLJP抑制小鼠鼻粘膜NLRP3炎性小体的激活和OVA诱发的Th17细胞的分化
WLJP抑制NLRP3、CASP1表达和NLRP3炎症小体激活(图2A)。WLJP显著抑制了OVA诱导的鼻粘膜组织中NLRP3炎症体元件(NLRP3、CASP1、IL-1β)蛋白表达的上调(图2B)。AR组中IL-17红色和p65绿色染色丰富,且p65主要在细胞核中表达,然而WLJP-L和WLJP-H组的IL-17和p65表达水平显著降低,只有少量p65在细胞核中表达(图2C)。同时,WLJP在鼻粘膜组织WB检测中以剂量依赖性方式抑制核p65易位和IL-17表达(图2D)。在流式细胞术分析中,观察到AR组的Th17细胞表达显著高于对照组,而WJLP-L和WLJP-H组的Th17-细胞表达均降低(图2E)。AR组血清IL-17(图2F)和IL-β(图2G)浓度增加,而WLJP-L和WLJP-H不同程度的抑制IL-17的释放。
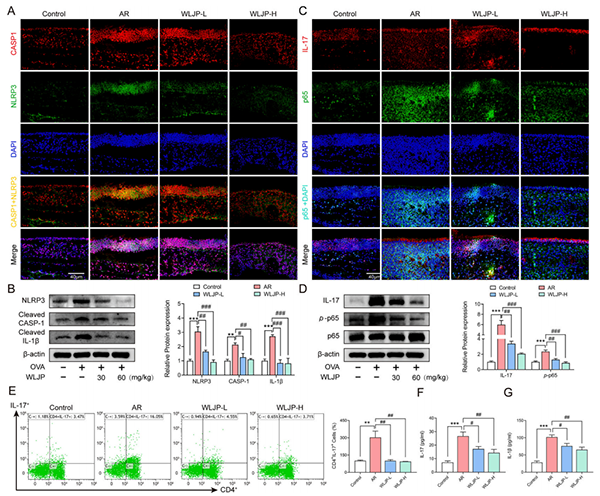
图2. WLJP抑制OVA诱导的相关炎症通路作用和Th17细胞分化
4.WLJP抑制小鼠肠道NLRP3炎症小体激活并减轻肠道屏障损伤
WLJP抑制结肠组织中AR诱导的NLRP3炎症小体活化(图3A)和NLRP3过度表达(图3B)。H&E染色显示小鼠结肠的病理变化如图3C。结果显示,WLJP抑制AR诱导的粘附连接蛋白β-连环蛋白和E-钙粘蛋白、紧密连接蛋白ZO1和闭塞蛋白表达的减少,肠粘膜上皮组织分布减少(图3D,E)。
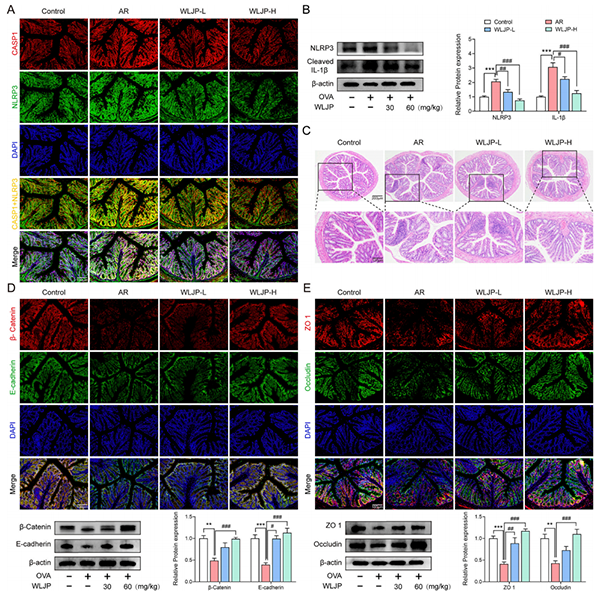
图3. WLJP减轻小鼠肠道屏障损伤并抑制肠道NLRP3炎症小体激活
5.WLJP可减轻OVA诱导的小鼠肠道微生物群的异常变化
进一步的肠道微生物分析显示,每组中同时出现了472个属(图4A),OVA和WLJP给药改变了微生物属的组成(图4B)。图4C是对前50个属水平细菌的相关性分析,其中有9个菌发生了显著变化。WLJP显著抑制AR诱导的小鼠肠道微生物群异常变化(图4D)。根据显著改变的属的丰度情况(图4E)和功能预测的结果(图4F),发现与炎症和免疫功能相关的基因比例发生了变化,表明肠道微生物与AR的发病机制以及WLPJ的改善有关。
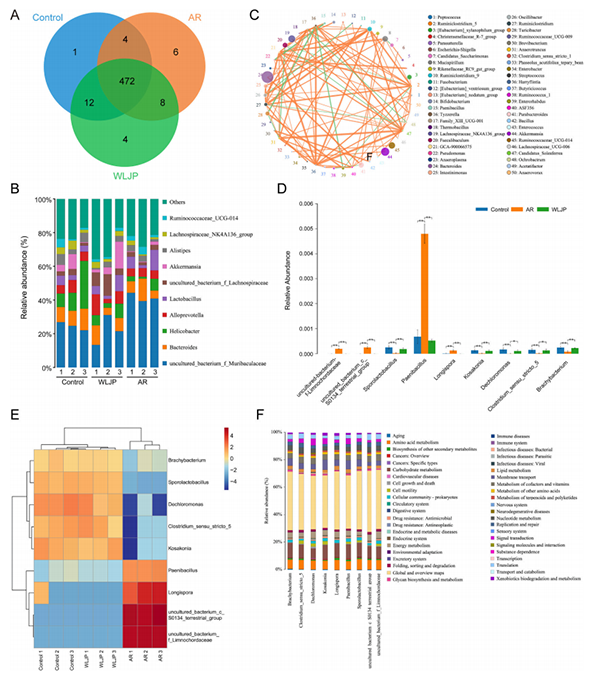
图4. WLJP可减轻OVA诱导的小鼠肠道微生物群的异常变化
6.分子对接和动力学模拟
通过模拟WLJP-025p的水解片段和NLRP3的可能作用模式(图5A),发现可能的结合位点如图5B所示。对停靠构象进行了50ns分子动力学模拟。首先分析了蛋白质-小分子配合物在分子动力学轨迹上的均方根偏差(Root Mean Square Deviation, RMSD),如图所示,持续10ns后,4个RMSD处于稳态,对10-50ns的轨迹进行采样和分析。其中5个GalA单体稳定结合在蛋白腔内,另外5个稳定结合在蛋白表面的凹槽内(图5C)。同时发现结合小分子的蛋白质结构整体是稳定的。大多数氨基酸的均方根波动(Root Mean Square Fluctuation, RMSF)在0.2nm以下,其中>0.2氨基酸位于C端和N端,即环区(图5D)。最后,发现小分子和蛋白质形成的氢键数约为10个(图5E)。
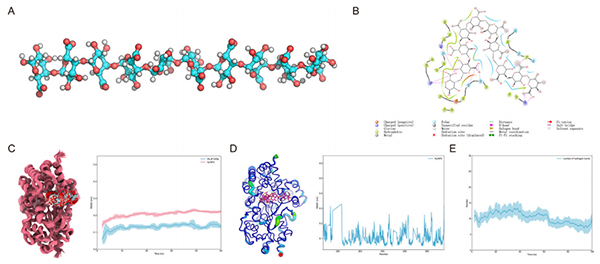
图5. 分子对接和动力学模拟
WLJP靶向NLRP3抑制巨噬细胞炎症
(12-)豆蔻酸佛波酯(-13-)乙酸盐(phorbol 12-myristate 13-acetate, PMA),诱导THP-1细胞成为巨噬细胞,联合NLRP3抑制剂研究WLJP的作用机制。图6A所示,WLJP和NLRP3抑制剂CY-09均不影响巨噬细胞的存活能力。在ELISA TNF-α(图6B)和IL-1β检测(图6C)中,发现WLJP和CY09均能抑制LPS+IFN-γ引起的炎症反应。随后对CY-09和WLJP组进行的交互分析,表明这两个因素对LPS+IFN-γ组的因变量TNF-α和IL-1β有显著的交互作用。巨噬细胞免疫荧光染色显示,WLJP和CY-09抑制NLRP3炎症小体活化(图6D)。在巨噬细胞WB分析中,观察到WLJP显著抑制NLRP3炎症小体活化和炎症表达,与鼻粘膜WB分析结果一致(图6E)。在NLRP3抑制剂CY-09中也观察到了同样的现象。同样,CY-09和WLJP组的相互作用分析显示了显著的相互作用。
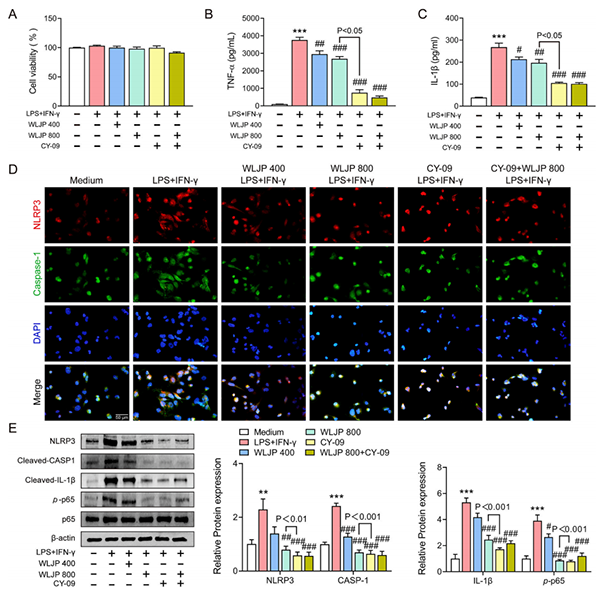
图6. WLJP靶向NLRP3抑制巨噬细胞炎症
结论
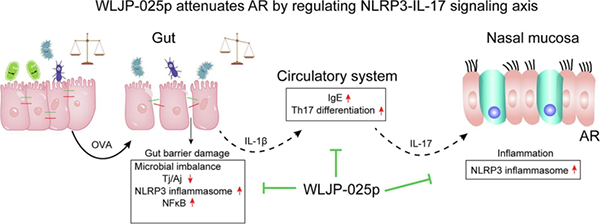
金银花的一种新型金银花多糖“WLJP”可能通过修复受损的肠道屏障、调控炎症免疫交互对话来改善AR。
文献下载链接:
https://pan.baidu.com/s/1QLL6lvDz86GRquOYw8OhnQ
提取码:0000