
文章标题:Multiomics identifies metabolic subtypes based on fatty acid degradation allocating personalized treatment in hepatocellular carcinoma
发表期刊:Hepatology
影响因子:12.9
客户单位:南京市鼓楼医院
百趣提供服务:新一代代谢组学NGM 2、脂质组学、转录组学
研究背景
肝细胞癌(Hepatocellular Carcinoma, HCC)是全球第六大常见癌症,位居癌症死亡原因的第四位,占原发性肝癌的85%-90%。当前HCC的治疗方案主要根据癌症的分期来进行决策,从局部切除到介入治疗再到免疫和靶向治疗。然而,即使是同一分期的患者也会对相同治疗产生不同反应,这凸显了找到预测疗效的生物标志物以支持临床决策的迫切性。癌细胞通常会改变脂肪酸代谢途径来获取能量和构建细胞膜所需的物质以维持其生长。尽管HCC中的脂肪酸合成途径已被深入研究,但脂肪酸降解(Fatty Acid Degradation, FAD)途径在癌细胞中的具体作用尚未得到充分挖掘。
因此,本研究招募了41名患者,分别进行转录组、脂质组、代谢组和蛋白组学分析,针对FAD途径进行系统性研究,提出基于该途径的HCC分子分型,以便更好地进行预后预测和个体化治疗策略制定。为了验证发现的FAD分型的稳健性,研究还重新分析了59个公开可用的数据集和通过动物模型对发现的结果进行进一步验证。
研究结果
1、转录组学和脂质组学揭示了HCC中FAD途径的特征
之前的报道发现能预测HCC的基因,通路分析发现这些基因与FAD通路相关(图1A),而参与这条通路的42个基因与线粒体β氧化等密切相关,且大部分与FAD相关的基因在肿瘤组织中都显著下降且与疾病进程正相关(图1B)。本研究中的数据也进一步验证FAD基因在肿瘤组织中显著下调,游离脂肪酸(Free Fatty Acids, FFAs)在肿瘤组织中显著上调(图1C)。通过ssGSEA方法计算的FAD评分反映了FAD途径的代谢活性,关联分析发现FAD评分与游离脂肪酸负相关(图1D),在乳腺癌组织中也有显示同样的关系。由此可看出FAD基因表达水平与FAD score均能反映FAD通路代谢活性及FFAs积累程度。FAD评分在正常肝脏和肾脏中较高而在肿瘤组织中较低(图1E),这一发现在单细胞转录组结果中得到进一步验证。但对36个公开数据的分析发现,FAD评分在HCC中显著降低(图1F),这一结果与肿瘤组织中FFAs浓度增加相对应(图1G)。此外,对多个小鼠HCC模型的分析发现FAD基因的表达水平下降。最后,单细胞RNA测序进一步证实了HCC中FAD评分的降低并揭示了细胞群体间的异质性(图1I、J),提示需要更精细的患者分层策略(图1J)。
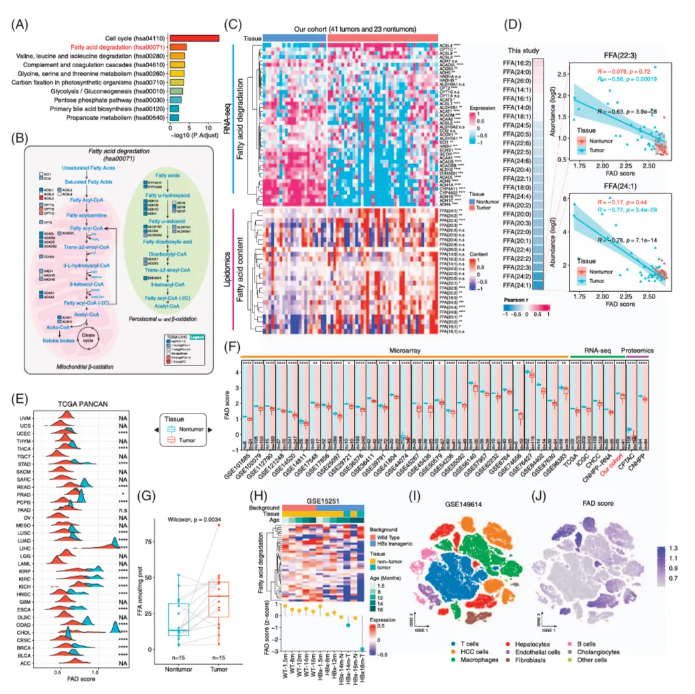
图1 FAD途径在多种癌症中下调及其与肿瘤中脂肪酸含量间的关系
2、HCC基于FAD分型的鉴定与验证及其临床病理学相关性
研究表明,FAD评分与HCC患者的总体生存率(Overall Survival, OS)和无复发生存率呈正相关。较低的FAD评分与晚期肿瘤分期、较大肿瘤体积及高AFP水平等具有侵袭性的临床指标相关。单变量和多变量分析表明FAD评分是所有数据集中OS的独立预后因子(图2A)。对42个FAD相关基因进行聚类分析,发现HCC患者被分成F1、F2和F3三个亚型,分别代表FAD基因低、中、高表达(图2B)。F1亚型FFAs含量较高,其他脂质(如TAG和DAG)较低,且与较高的AFP水平及晚期肿瘤分期相关。F1亚型患者OS和无复发生存时间最短,而F3亚型最长(图2C)。HCC基于FAD的分型在另外8个数据中得到验证;FAD亚型的预后价值在5个独立队列中得到了进一步验证(图2D-H),即使根据肿瘤级别分型,FAD亚型也与患者的疾病进程相关。
综合来看,这些结果表明FAD分类在不同数据集中稳定,并且与具有预后价值的临床病理指标相关。虽然目前已经报道了很多不同的HCC亚型,通过比较发现基于FAD的亚型的基因数最少且较少基因出现在其他疾病标志物中;且FAD亚型相关的基因在其他HCC亚型中也有出现。

图2 基于FAD的HCC亚型及其临床病理相关性识别与验证
3、肝细胞癌FAD亚型的基因组、表观遗传、代谢和信号通路特征
作者进一步探讨了FAD亚型的基因组、表观遗传学、代谢和信号特征。拷贝数变异分析显示,F1亚型在10号和12号染色体上有更多扩增,而F3亚型在1p和4q染色体上的缺失较少。表观遗传分析表明FAD基因在F1亚型中的甲基化率更高,其表达与甲基化水平呈负相关,暗示DNA甲基化可能导致FAD通路在HCC中的失活(图3A-E)。
F1亚型表现出糖酵解、核苷酸代谢及增殖信号通路的关键酶显著上调,表明其对能量生成和大分子合成的需求增加。F1亚型的TGF-β、NOTCH和RAS信号通路活性较高,而F3亚型的AKT/mTOR通路活性相对较高;F1亚型的糖酵解活性最高,而F3的氧化磷酸化(oxidative phosphorylation, OXPHOS)活性更高。FAD分类在肝癌细胞系中显示,常用细胞系如Hep3B和MHCC97H属于F1亚型,而HepG2和C3A属于F3亚型(图3F-H)。
亚组特异性通路富集分析揭示了三个FAD亚型的独特分子特征。F1亚型在糖酵解、核苷酸代谢和增殖信号通路中较高,而F3亚型富集于肝脏特异性代谢通路,如胆汁酸和酮体代谢通路。HCC生物标志物在FAD亚型中的表达模式显示,F1亚型富集于多个不良预后的标志物,F3亚型则显示较高的GLUL、GLYATL1和CPS1表达。FAD分型和富集分析结果在单细胞转录组数据中得到验证。FAD亚型将HCC患者分为三组,其特定的基因组、表观遗传学、代谢和分子特征可能使其对现有治疗药物更为敏感(图3I-L)。
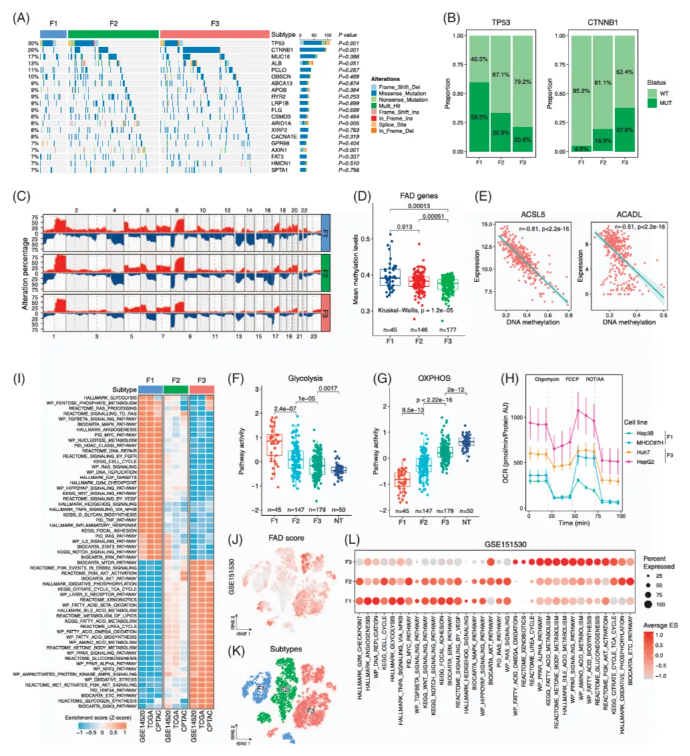
图3 肝细胞癌FAD亚型的基因组、表观遗传、代谢和信号通路特征
4、探索针对肝细胞癌FAD亚型特异性药物
数据表明YM-155和Alisertib是F1亚型的特异性药物,未发现F3亚型的特异药物(图4)。与F1亚型相关的大部分药物靶点基因在F1亚型中都显著升高且与FAD score负相关;增殖实验表明,F1亚型细胞系对YM-155和Alisertib药物更敏感。
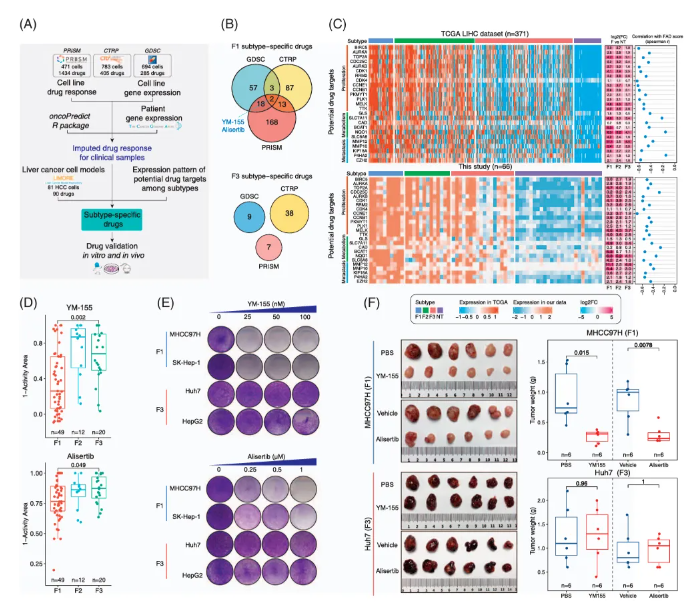
图4 探索肝细胞癌FAD亚型特异性药物
5、FAD亚型与索拉菲尼和TACE的反应关系
作者评估了FAD亚型与HCC治疗中常见药物之间的关系,综合来看,实验数据表明F1亚型患者对索拉非尼更敏感,而F3亚型对经动脉化疗栓塞(Transarterial Chemoembolization, TACE)有反应(图5)。

图5 FAD亚型与索拉菲尼和TACE的反应关系
6、肝细胞癌FAD亚型的肿瘤微环境(TME)特征
RNA-seq队列结果显示,F1亚型的共刺激因子、共抑制因子、配体和受体基因表达最高,且其免疫细胞标志基因的含量显著高于其他亚型。F1来源的T细胞表现出更高的细胞毒性和耗竭标志物,表明其具有更强的免疫浸润和抑制状态。
接着用2个自建的小鼠模型和11个来自公共数据集的小鼠模型数据对FAD亚型进行验证,发现HCC被分为3个亚型;其中NRAS诱导的模型属于F1亚型,而AKT驱动的模型属于F3亚型。F1亚型小鼠的T细胞浸润情况明显高于F2和F3亚型,显示出更强的免疫浸润及抑制微环境(图6A-C)。
进一步使用scRNA-seq技术分析FAD亚型小鼠的免疫景观,F1模型中T细胞丰度较高,而F3模型则以巨噬细胞为主。F1来源的T细胞具有更丰富的细胞毒性和耗竭特征,同时,F1肿瘤中的恶性细胞与T细胞的相互作用更为频繁,提示F1亚型中存在PD-1/PD-L1介导的免疫抑制(图6D-P)。

图6 FAD亚型HCC的肿瘤微环境(TME)的特征
7、FAD亚型可预测对免疫检查点抑制剂单药治疗及联合治疗的反应
研究表明,FAD亚型的HCC与免疫治疗反应相关。F1亚型小鼠模型对抗PD-1治疗有效,而F2和F3亚型模型则无反应。临床数据显示,F1亚型患者中77.8%为PD-1反应者,显著高于F2(25%)和F3(0%)。在“亚洲PD1队列”中,F1亚型的抗PD-1反应率为61.1%。FAD评分在预测抗PD-1反应方面表现良好,AUC为0.855。同时,FAD亚型也能预测抗PD-L1单药治疗的反应。低FAD评分与T+A治疗的总生存期和无进展生存期改善相关,而F1亚型患者在接受T+A治疗时展现出最佳生存收益(图7)。

图7 FAD亚型可预测免疫检查点抑制剂单药治疗及联合治疗的反应
8、FAD亚型特异性的血清生物标志物及肝细胞癌的治疗策略
肝活检并非诊断HCC的必需步骤,这可能会阻碍FAD亚型在临床中的应用,基于代谢组学和蛋白质组学的研究结果表明,外周血中的代谢物和蛋白质特征能够以高准确性和敏感性区分FAD亚型(图8A-D)。
最后,作者提出了一种基于液体活检的诊断算法,旨在将FAD亚型应用于临床实践(图8E)。
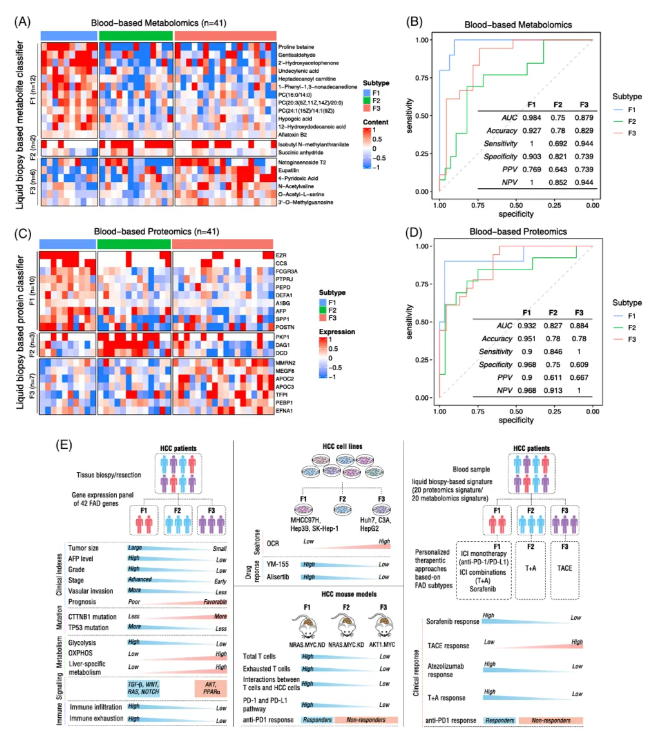
图8 FAD亚型特异性的血清生物标志物及肝细胞癌的治疗策略
研究结论
该研究提出的FAD分型系统,为HCC的分子分类提供了新的视角,帮助识别出个体化治疗的潜在候选药物。此外,研究也表明FAD分型可以通过液体活检进行诊断,从而优化患者的治疗决策,特别是在预测对免疫检查点抑制剂的反应方面具有潜在应用价值。