癌症的一个基本标志是代谢重编程,是由于代谢途径和信号通路之间存在多种、且通常很复杂的相互作用共同导致的。此外,内在因素(基因组/表观基因组改变) 和外在因素(营养物质、药物、激素以及与基质细胞、细胞外基质和免疫系统的相互作用) 都有助于癌细胞的代谢重编程 [3]。癌症导致癌细胞和正常组织的代谢改变,进而与内在和外在因素相互作用,影响全身代谢(图1) 。代谢组学是一种基于系统的方法,可以用于定义这些复杂的代谢相互作用的诊断和治疗[3]。
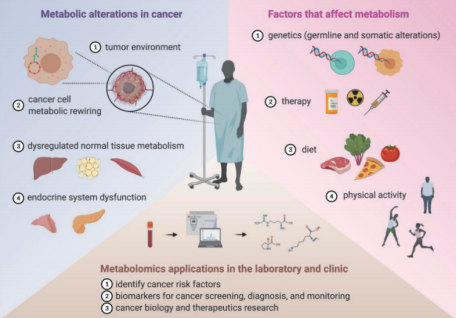
图1 癌症和代谢在多个层面相互作用
 针对新陈代谢的癌症疗法
针对新陈代谢的癌症疗法多种机制都可能导致癌症中的代谢重编程,但不管潜在的机制是什么,如果代谢酶活性是肿瘤维持所必需的(通常称为代谢依赖性),并且宿主代谢可以容忍对代谢酶活性的抑制,那么代谢酶活性的改变就为治疗干预提供了机会[3]。
从癌症研究的早期开始,就认为癌细胞增殖指数的增加是一种代谢脆弱性。观察到快速增殖的细胞可以被干扰DNA复制的药物杀死,这促进了第一批化疗药物的开发,包括具有直接基因毒性作用的小分子[3]。除了针对核苷酸和DNA合成,早期癌症治疗还针对其他代谢途径。例如人们发现急性淋巴细胞白血病细胞的生长依赖于外源性天冬酰胺[4],这促使使用L-天门冬酰胺酶来限制天冬酰胺的供应,进而抑制白血病细胞生长 [5];再例如针对癌细胞中异常调节的中枢代谢途径(糖酵解、三羧酸循环和脂肪生成) 。但是以中枢代谢途径为靶点总是会引发关于治疗窗口的问题,因为全身代谢的改变可能会产生有害影响。直接针对糖酵解途径治疗也证明了这一观点,因为葡萄糖摄取抑制剂的治疗指数低,会同时影响癌细胞和正常细胞的葡萄糖摄取[6,7]。
氨基酸也是支持癌细胞同化代谢的重要营养物质。谷氨酰胺是血液中最丰富的氨基酸,在许多癌细胞系中已经观察到谷氨酰胺依赖性 [8]。靶向谷氨酰胺酶的药物,如CB-839和IPN60090,在一些临床前模型中是有效的,目前正在进行各种恶性肿瘤的试验[9-11]。与大多数正常组织相比,癌细胞对生成脂膜和信号分子前体的脂肪酸的需求增加[12]。脂肪生成酶在许多癌细胞中上调,从头合成脂肪酸被视为癌细胞的潜在治疗靶点[13,14]。
尽管大多数针对代谢的药物并不区分癌症和正常细胞,但在IDH(Isocitrate dehydrogenase) 突变的癌症中,有一个独特的机会可以选择性地针对癌细胞。事实上,已经开发出了几种选择性的针对突变酶的靶向药物[15-17]。值得指出的是,在许多实体瘤类型中,针对代谢酶的药物在临床前模型中能有效减缓肿瘤生长,但很少观察到肿瘤消退,这表明其中一些药物作为多药方案的一部分或作为维持疗法可能最有用[3]。
 癌症的全身代谢效应
癌症的全身代谢效应体重下降是癌症患者常见的症状,超过一半的癌症患者在基线检查时出现厌食症,其病因尚不清楚[18-20]。在一些癌症患者中已经观察到静止能量消耗的增加,它发生的概率可能取决于癌症类型,这表明高代谢可能是某些癌症的特征,进而导致了体重下降 [21,22]。癌症恶病质和体重减轻也与全身代谢变化有关,包括葡萄糖、脂质和蛋白质代谢的紊乱[23‒26]。这些系统性代谢的改变被归因于肿瘤诱导的宿主代谢的变化,而不是肿瘤本身的代谢活动 [27]。但不得不说的是,癌症的全身代谢影响是异质性的,还有很多问题有待挖掘。
在大多数情况下,早期的研究未能显示早期局部癌症患者的显著代谢变化,这导致了观察到的代谢变化是由与癌症相关的消耗表型来表现,而不是由于癌症本身直观体现[27]。随着检测技术的进步,改进了代谢物检测问题,使得在癌症患者中发现了独特的系统性代谢特征,甚至在疾病早期阶段的某些特定情况下,没有明显临床症状之前检测代谢特征[28]。
 癌症治疗的代谢效应
癌症治疗的代谢效应除了癌症引起的全身代谢变化外,通过手术、放疗、全身或激素治疗治疗癌症会导致急性和长期的副作用,涉及消化系统的副作用是影响代谢的大部分急性治疗相关毒性[29]。接受头颈部和胃肠道恶性肿瘤治疗的患者中很常见的是由恶心、呕吐、腹泻、粘膜炎、味觉障碍引起的营养不良和体重减轻。尽管积极的癌症治疗的急性代谢副作用会很明显,但长期的副作用往往更为微妙。发病率和严重程度取决于治疗方式和治疗后的间隔时间 [30]。除了涉及垂体、甲状腺、肾上腺、胰腺和性腺的手术或放疗后内分泌/外分泌功能下降的长期后遗症外,关于这些方式的长期代谢影响的数据相对较少 [31]。已有关于癌症治疗的长期代谢效应和潜在的病理生理机制的研究,但之前的大部分数据都不足以确定因果关系。在临床试验和监测方案中更广泛地使用代谢组学分析,可以更好地理解病理机制,并确定干预的机会[3]。
 饮食和生活方式在癌变和治疗反应中的作用
饮食和生活方式在癌变和治疗反应中的作用流行病学研究表明,癌症发病率与有害代谢状态(包括肥胖和糖尿病) 呈正相关 [32‒34];饮食因素和缺乏运动也与此有牵连[35‒37]。此外,在诊断后的情况下,这些因素与某些癌症的疾病进展、复发风险和死亡率的相关性已得到证实。总的来说,这些数据促使人们采纳了关于健康食品选择和体育活动的指导方针,以降低癌症风险[36]。
从概念上讲,膳食成分可以影响循环营养物质和代谢激素,从而直接影响肿瘤细胞内的代谢[3]。虽然饮食、运动和全身代谢状态对癌症起始的影响在实验上具有挑战性,但饮食对肿瘤进展的影响已经在各种癌症的小鼠模型中得到了广泛的评估,包括乳腺癌、前列腺癌、肺癌、胰腺癌、肝脏和其他 [38]。与人类数据一致,啮齿类动物的实验室研究通常支持这样的观点,即在某些情况下,热量限制和生酮饮食可以减缓肿瘤生长,而高脂肪饮食可以促进肿瘤进展[39-43]。然而,也有研究证明这是一种明显的过度简化的现象,饮食对肿瘤进展的影响可能也取决于肿瘤遗传学和肿瘤微环境 [44,45]。此外,从机制上讲,很难确定个体营养物质在多大程度上直接影响肿瘤生长,而不是间接影响生长因子信号传导。除了影响癌变外,饮食和生活方式因素也可能影响癌症治疗[46 ‒48]。某些特定氨基酸的缺失可以减缓一些肿瘤的生长 [49,50-54]。结合基因组学、蛋白组学、代谢组学和生物标记物的多组学方法可能会更有效地来研究其中的关联。
 当前代谢组学与临床肿瘤学研究成果小结
当前代谢组学与临床肿瘤学研究成果小结在癌细胞中,代谢发生失调支持不受控制的增值需求 [55-57]。这种细胞代谢的重新连接导致了特征性的代谢表型,可用于早期临床试验患者癌症诊断的选择策略,可作为治疗反应的生物标志物。代谢的改变也会导致独特的代谢依赖性,在某些情况下可以通过精确的医学和营养来靶向调节,包括选择性地靶向代谢酶的药物[58,59]。癌症和癌症治疗还可以改变全身水平的代谢,并以复杂的方式与饮食和运动的代谢效应相互作用,这可能会影响癌症的结果以及患者的生活质量。
从基因克隆技术开始到后来的癌症基因发现,在基因组时代的大部分时间里,癌症生物学专注于信号通路和转录因子如何控制癌症生长和细胞周期。然而,近年来,人们对了解代谢的改变如何促进癌症的发病机制重新产生了兴趣。许多因素,如肿瘤缺氧、基质组成、免疫细胞浸润和基因改变在定义癌细胞代谢中都起着关键作用[3]。
在概念上,代谢组学与其他组学不同,因为它提供了代谢过程的功能读数,因此是表型的直接评估 [60]。也就是说,代谢组学如果解释得当,可以提供DNA、RNA和蛋白质水平上发生的全部改变的读数,在某些情况下,可能是识别病理变异最敏感的方法,因为即使是蛋白质表达或结构的微小变化也会导致蛋白质活性和代谢物水平的显著变化。相反,代谢物可以改变蛋白质活性,从而影响几乎每一个生物过程,包括DNA复制、RNA转录和翻译。简言之,癌症是由基因组水平的变化引起的,这些变化导致RNA转录、蛋白质表达和蛋白质功能的改变。代谢组提供了这些上游变化的功能性读数。反过来,个体代谢物影响蛋白质活性,从而改变RNA转录和DNA复制(图2)。表观代谢物一词被用来描述作为活性生物标志物的代谢物子集,并参与不同的生物功能,包括表观遗传调节、肿瘤发生、癌细胞侵袭、癌症干细胞多能性、胰岛素敏感性和其他细胞过程 [61]。此外,代谢组学还考虑到了肿瘤环境的改变,包括可以对肿瘤
亚克隆施加选择压力的治疗干预[62]。
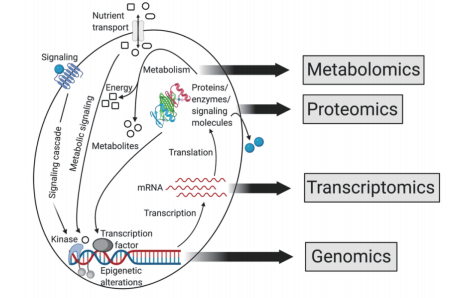
图2 系统生物学组学方法之间的关系
代谢组学在临床应用上利用癌症的代谢特征来评估疾病风险,或用于早期癌症筛查、特定疾病亚群诊断或治疗监测。代谢组学原则上也可以帮助合理选择靶向治疗,以配合癌症的代谢依赖性[3]。
虽然与其他“组学”方法相比,代谢组学的应用较少,但它有可能显著影响肿瘤的核心领域,包括筛查、诊断和治疗。然而,这样的应用需要更好地理解这些分析是如何与人类生理学和癌症生物学联系的。在临床上很容易获得的生物液体中,尤其是血浆,我们对可以测量什么代谢物来反映癌症状况的理解还处于非常早期的阶段。尽管已经有了一些研究进展[63,64,65],但仍不清楚血浆中的代谢物图谱在多大程度上揭示了癌症的代谢活动。另外一个很有希望的新方向是,在携带癌症的液体中进行代谢组学实验,并将这些检测与代谢和肿瘤生物学联系起来。关于如何从这些检测中解释癌症代谢,还有很多有待了解[3]。
代谢组学的挑战之一是存在大量的、化学性质复杂的代谢物。例如,血浆代谢物组成是肝脏、肌肉等器官水平代谢、饮食摄入量、菌群活性等因素的表现。目前,代谢组学在研究中的最佳应用是与其他组学方法和假设驱动的研究相结合,以发现癌细胞的功能和诊断相关的改变。预计,随着标准化的方案、先进的仪器和完善的分析平台的助力,代谢组学将与临床和床旁的其他诊断和预后检测一起发挥越来越重要的作用[3]。










