01
蛋白质翻译后修饰与磷酸化修饰的关系
蛋白质翻译后修饰(Post-Translational Modifications, PTMs)是指在蛋白质合成完成之后,通过添加化学基团或蛋白质间的化学交互作用来改变蛋白质的结构和功能的过程。修饰作用可以改变蛋白质的电荷、空间结构、稳定性和亲和性,从而调节蛋白质的功能、定位、相互作用和降解。PTMs增加了细胞蛋白质组的复杂性,为细胞提供了更多的功能和适应性。
在组成蛋白质的20种氨基酸中,至少15种氨基酸已被报道能够发生修饰作用。同时,在同一种氨基酸上可以发生多种修饰。目前超过680种修饰类型被发现并报道,包括磷酸化(Phosphorylation)、泛素化(Ubiquitination)、类泛素化(Ubiquitin-like modification)、甲基化(Methylation)、乙酰化(Acetylation)和糖基化(Glycosylation)等等。众多的修饰类型进一步增加了蛋白质的复杂性,这使多种生物学过程及信号通路受到影响。
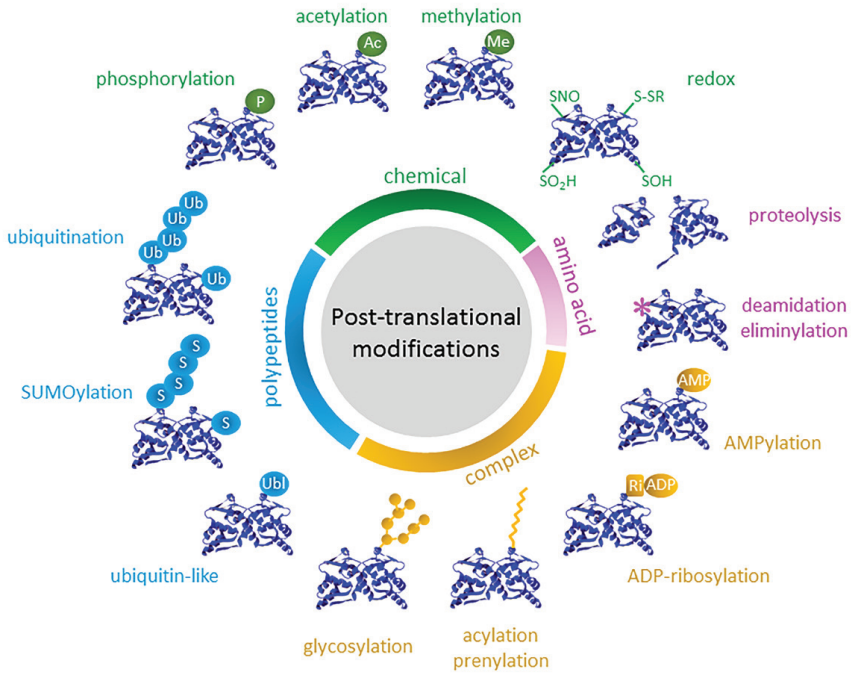
图1 蛋白质翻译后修饰的多样性和复杂性[1]
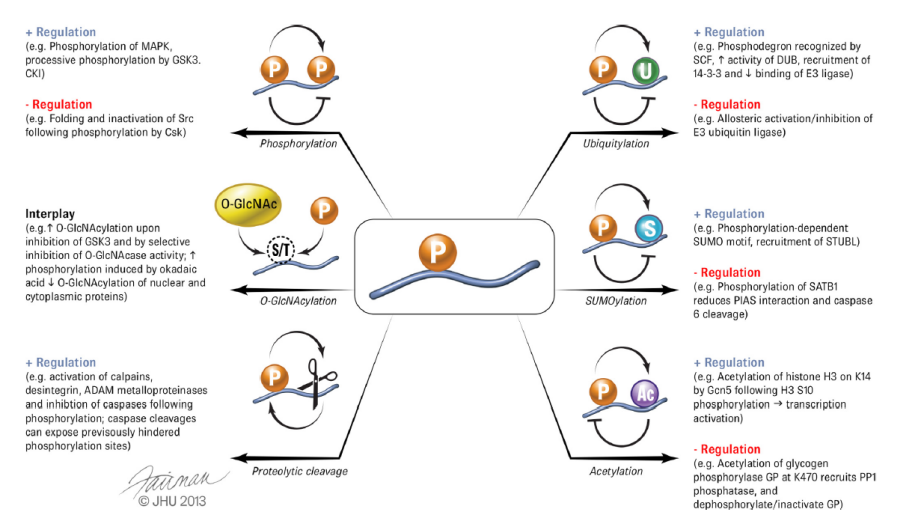
图2 蛋白质磷酸化与其他修饰之间的Crosstalk[2]
02
蛋白质磷酸化修饰主要特点
蛋白磷酸化是最常见的可逆PTMs,它是指在蛋白激酶的作用下,将ATP或GTP的磷酸基团转移到底物蛋白质氨基酸残基上的过程,其可逆过程指的是在磷酸酯酶作用下,将发生磷酸化修饰的蛋白质中的磷酸基团脱除下来的过程。
据报道,有超过500种激酶和100种磷酸(酯)酶参与了蛋白质磷酸化和去磷酸化过程,这一可逆过程与细胞信号传导密切相关。研究发现,生物体的真核细胞中约有1/3的蛋白质发生磷酸化修饰作用,其中发生磷酸化修饰的位点主要集中在丝氨酸、苏氨酸和酪氨酸上,其比例约为1800:200:1。
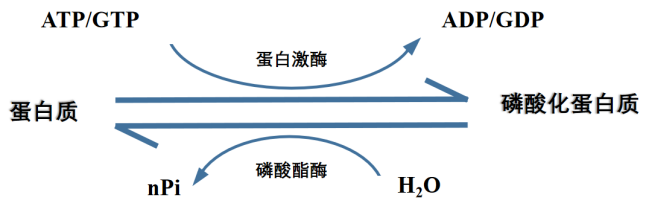
图3 蛋白质磷酸化修饰形成过程
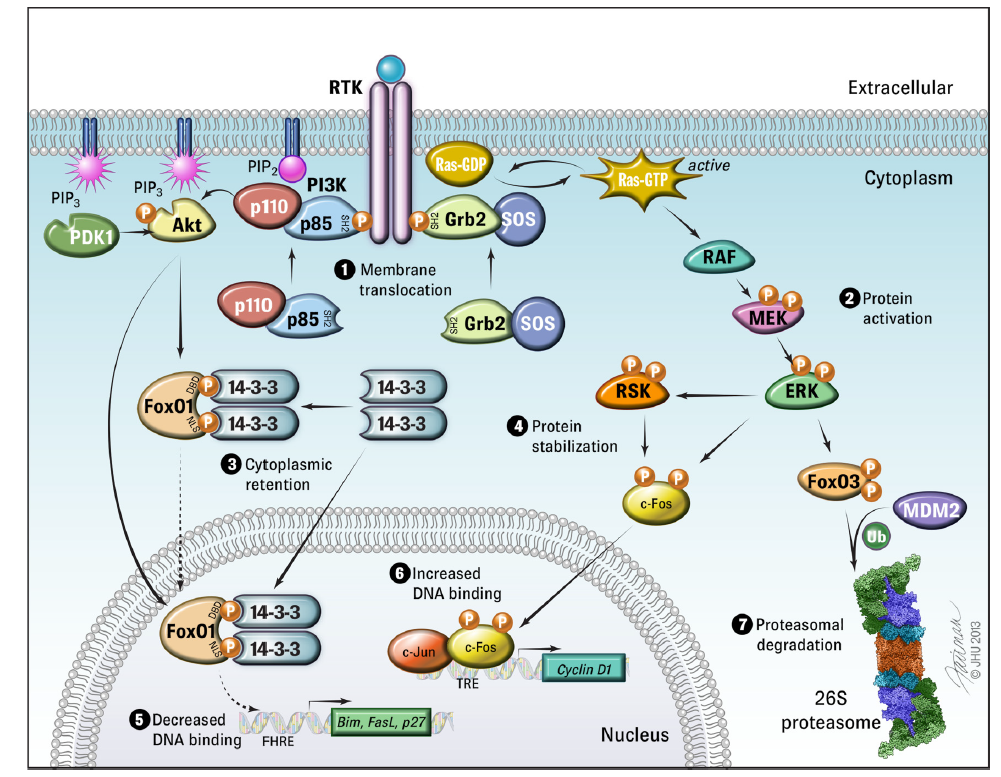
图4 蛋白质磷酸化的重要功能[2]
03
磷酸化蛋白质组学的定量分析方法
磷酸化蛋白质组学的定量方法主要有两大类:非标记定量法和标记定量法。
(1)非标记定量法
非标记蛋白质组定量技术是一种不依赖于同位素标记的蛋白质定量技术,该技术通过液质联用对蛋白质酶解肽段进行检测,分析大规模鉴定蛋白质时所产生的质谱数据,常与数据非依赖采集(Data independent acquisition, DIA)或数据依赖采集模式(Data dependent acquisition, DDA)质谱扫描模式相结合。
(2)标记定量法
标记定量蛋白质组学技术是一种多肽体外标记定量技术。采用多种同位素的标签,可与氨基(包括氨基酸N端及赖氨酸侧链氨基)反应实现连接,通过高精度质谱分析,同时实现多个样本蛋白组的定性和定量。
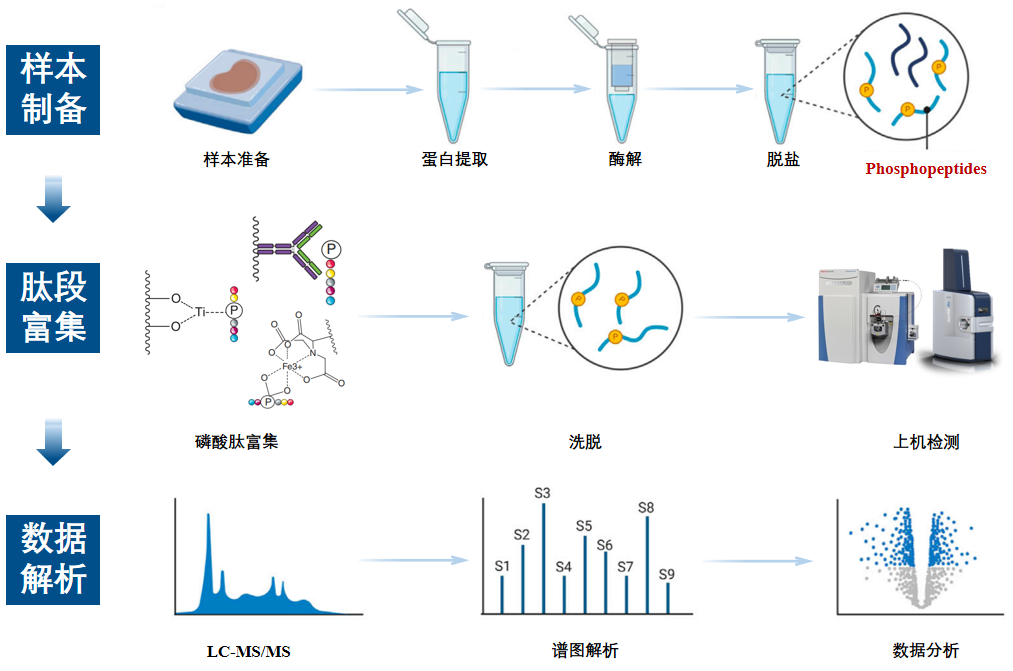
图5 磷酸化蛋白质组学实验流程
04
磷酸化蛋白质组学流程中的特别之处——肽段富集
磷酸化肽段在细胞所有肽段中的比例很低,非磷酸化修饰肽段的大量存在会覆盖磷酸化肽段信号,直接影响磷酸化蛋白质组的检测和定量。因此需要对磷酸化肽段进行针对性富集,增加磷酸化蛋白质组的通路及定量准确性。磷酸化肽段富集常用的富集方法主要为固相金属离子色谱(Immobilized metal affinity chromatography, IMAC)、金属氧化物亲和色谱(Metal oxide affinity chromatography, MOAC)以及利用磷酸化抗体特异性富集的免疫沉淀法。其中IMAC和MOAC富集方法应用最广。
IMAC原理:是利用磷酸基团与固相化的Fe3+、Ga3+、Al3+、Cu2+等金属离子的高亲和力来富集磷酸肽。
MOAC原理:与IMAC相似,MOAC的主要亲和位点也是金属阳离子,但与IMAC不同的是,MOAC中金属阳离子与相邻的阴离子之间的化学键更坚固,可以克服IMAC中金属阳离子流失的问题。常用的MOAC试剂包括二氧化钛(TiO2)、二氧化锆(ZrO2)和四氧化三铁(Fe3O4)等等。
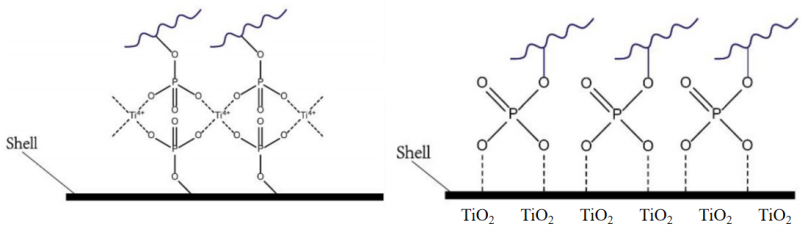
图6 IMAC(左)和MOAC(右)原理示意图
05
磷酸化修饰蛋白质组学的应用案例
案例一:磷酸化与信号转导研究[3]
英文标题:Phosphoproteomics Reveals the GSK3-PDX1 Axis as a Key Pathogenic Signaling Node in Diabetic Islets
中文标题:磷酸蛋白质组学揭示了GSK3-PDX1轴作为糖尿病胰岛的关键致病信号节点
发表期刊:Cell Metabolism
影响因子:29.0
组学技术:Label free定量蛋白质组学+磷酸化修饰蛋白质组学
研究内容:2型糖尿病(Type 2 diabetes, T2D)是一种以胰岛素抵抗和β细胞功能障碍为特征的进行性疾病。磷酸化可以调节葡萄糖刺激的β细胞胰岛素分泌,但体内糖尿病胰岛的信号网络如何重塑仍不清楚。本文对正常小鼠和肥胖糖尿病小鼠的胰岛组织进行采集,采用Label-free定量蛋白质组学和定量磷酸化修饰组学技术对其蛋白质进行鉴定和分析。结合生物信息学,获得正常和糖尿病小鼠胰岛蛋白和磷酸化蛋白质组的信号网络图,从磷酸化角度探索调控胰岛素分泌的关键信号通路。结果发现,GSK3-PDX1轴是控制胰岛素分泌的关键信号节点,抑制GSK3能恢复胰腺β细胞面对高糖处理时正常分泌胰岛素的能力。
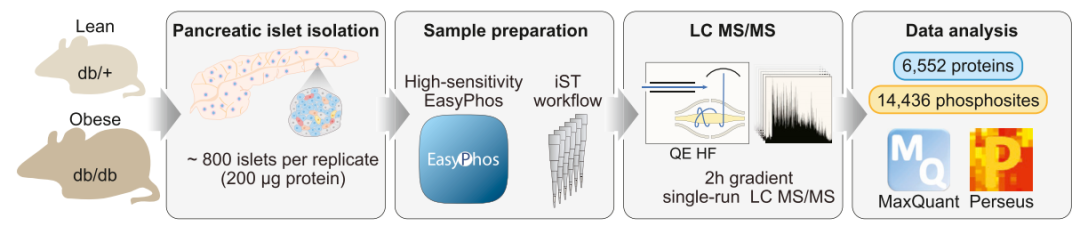
技术路线
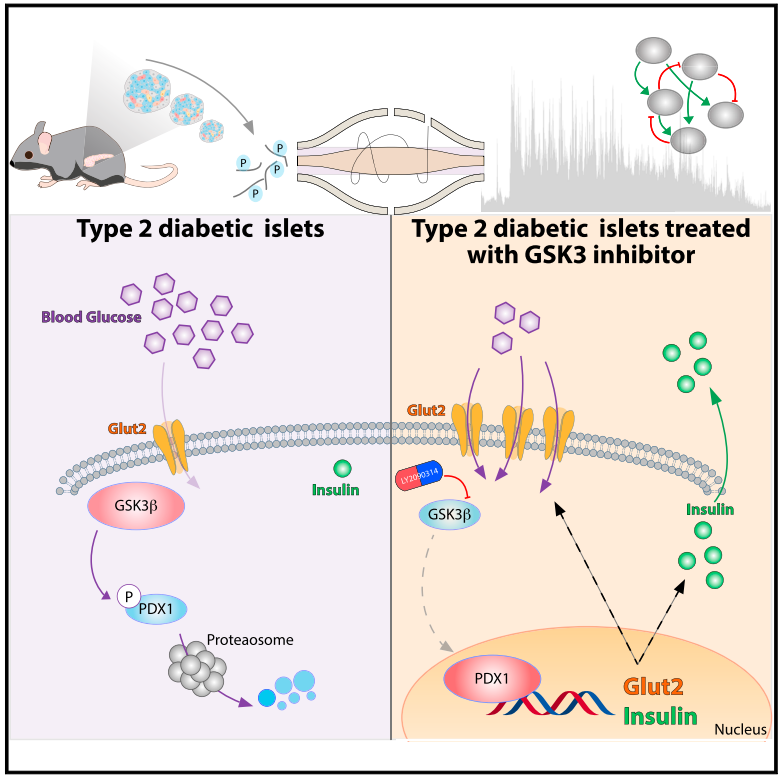
GSK3-PDX1轴是控制胰岛素分泌的关键信号节点
案例二:磷酸化与生物标记物筛选[4]
英文标题:Phosphoproteomic analysis of neoadjuvant breast cancer suggests that increased sensitivity to paclitaxel is driven by CDK4 and filamin A
中文标题:新辅助治疗乳腺癌的磷酸蛋白组学分析揭示影响紫杉醇敏感性的背后机制
发表期刊:Cell Metabolism
影响因子:16.6
组学技术:磷酸化修饰蛋白质组学
研究内容:乳腺癌的发病率逐年上升,肿瘤异质性为乳腺癌的精准诊疗带来巨大挑战。磷酸化蛋白质组学可以了解蛋白质的磷酸化状态,揭示以激酶活性为特征的患者亚群,为精准医学和个性化治疗提供重要支持。本研究对接受紫杉醇治疗的her2阴性乳腺癌患者(N = 130)进行了磷酸化蛋白质组学分析,旨在寻找紫杉醇敏感性的候选生物标志物。通过2个独立的患者组(N = 218)筛选了11个候选生物标志物,可以鉴定出具有高水平CDK4和细丝蛋白A(filamin A)特征的患者亚组。在机制上,CDK4调节细丝蛋白A的转录,细丝蛋白A可以与微管蛋白和CLIP-170形成复合物,导致微管的乙酰化和稳定增加,使紫杉醇更容易结合到微管上。这些效应相结合,导致了有高水平CDK4的肿瘤对这种药物的敏感性增加,从而引发有严重后果的有丝分裂异常。
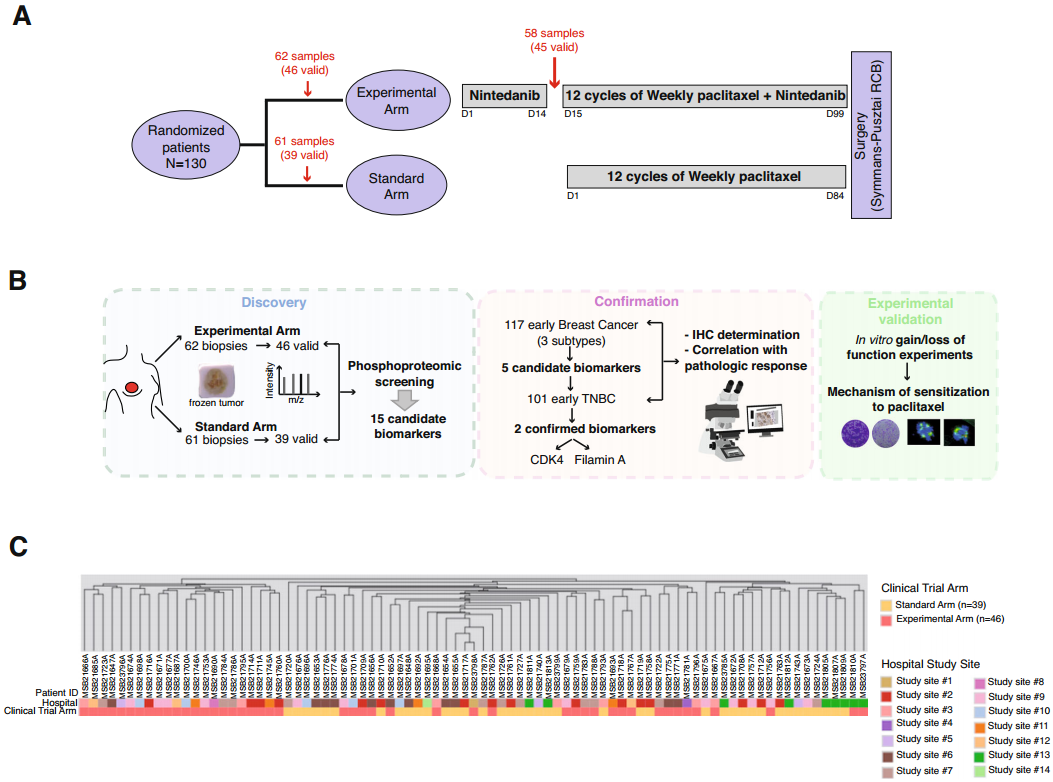
临床试验治疗和队列设计
案例三:磷酸化与植物逆境胁迫研究[5]
英文标题:Calcium-dependent activation of CPK12 facilitates its cytoplasm-to-nucleus translocation to potentiate plant hypoxia sensing by phosphorylating ERF-VII transcription factors
中文标题:磷酸化修饰蛋白质组学揭示植物低氧感知新机理
发表期刊:Molecular Plant
影响因子:27.5
组学技术:磷酸化修饰蛋白质组学
研究内容:钙依赖性蛋白激酶(Calcium-dependent protein kinases, CDPKs/CPKs)是植物应激信号传导的关键调节因子,可以通过磷酸化多种底物蛋白将钙信号转化为细胞反应。然而,植物细胞在缺氧条件下传递钙信号的分子机制尚不清晰。本研究通过磷酸化蛋白质组学分析,发现拟南芥中CDPK家族成员CPK12,在缺氧时通过其Ser-186残基的钙依赖性磷酸化而迅速激活。磷酸化的CPK12从细胞质转运到细胞核,与磷酸化植物缺氧感应的核心调控因子ERF-VIIs相互作用,增强其蛋白稳定性,从而促进植物对低氧胁迫的感知和信号转导。
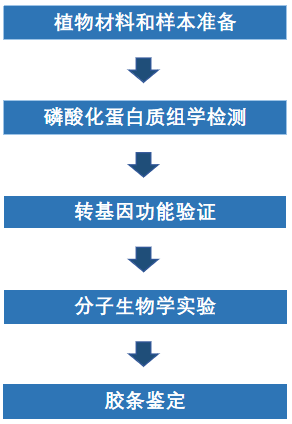
实验流程
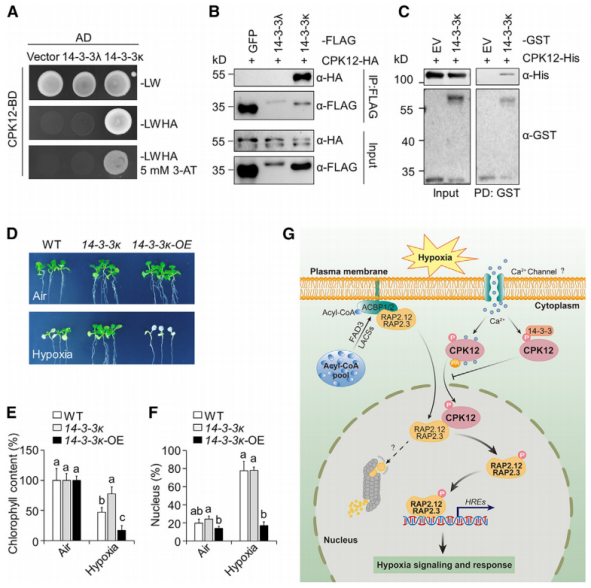
负向调节缺氧诱导的CPK12转运
百趣生物致力于提供全面式的蛋白质组学检测分析服务,涵盖修饰蛋白质组学、定性蛋白质组学、非靶向定量蛋白质组学、靶向定量蛋白质组学、互作蛋白质组学等,欢迎感兴趣的老师前来咨询~
06
参考文献
[1] Spoel Steven H,Orchestrating the proteome with post-translational modifications.[J] .J Exp Bot, 2018, 69: 4499-4503.
[2] Roux Philippe P,Thibault Pierre,The coming of age of phosphoproteomics--from large data sets to inference of protein functions.[J] .Mol Cell Proteomics, 2013, 12: 3453-64.
[3] Sacco Francesca,Seelig Anett,Humphrey Sean J et al. Phosphoproteomics Reveals the GSK3-PDX1 Axis as a Key Pathogenic Signaling Node in Diabetic Islets.[J] .Cell Metab, 2019, 29: 1422-1432.e3.
[4] Mouron S,Bueno M J,Lluch A et al. Phosphoproteomic analysis of neoadjuvant breast cancer suggests that increased sensitivity to paclitaxel is driven by CDK4 and filamin A.[J] .Nat Commun, 2022, 13: 7529.
[5] Fan Biao,Liao Ke,Wang Lin-Na et al. Calcium-dependent activation of CPK12 facilitates its cytoplasm-to-nucleus translocation to potentiate plant hypoxia sensing by phosphorylating ERF-VII transcription factors.[J] .Mol Plant, 2023, 16: 979-998.