
英文标题:Extreme Tolerance of Nanoparticle-Protein Corona to Ultra-High Abundance Proteins Enhances the Depth of Serum Proteomics
中文标题:纳米颗粒-蛋白冠对超高丰度蛋白质的极强耐受性增强了血清蛋白质组学的深度
发表期刊:Advanced Science
影响因子:14.1
研究背景
血清蛋白质组学在生物标志物发现与疾病诊断中具有关键价值,但血清中蛋白质浓度跨度约10个数量级,超高丰度蛋白(如占比达52.0%的人血清白蛋白HSA)易掩盖低丰度生物标志物信号,严重限制检测深度。传统提升蛋白质组学深度的方法存在操作繁琐、成本高昂的问题,难以应用于大规模临床样本。
纳米颗粒-蛋白冠(NPC)是纳米颗粒(NPs)进入生物环境后表面吸附蛋白质形成的结构,其能赋予纳米材料新的生物特性,且基于NPC的纳米蛋白质组学已在肺癌、卵巢癌等疾病的生物标志物研究中展现潜力。然而,目前对NPs与蛋白质的相互作用机制、NPC如何提升血清蛋白质组学深度的核心原理,以及决定NPC蛋白组成的关键因素仍不明确,亟需通过系统实验揭示其内在规律,为NPC在血清蛋白质组学中的精准应用奠定基础。
技术路线
研究结果
1、血清浓度依赖性纳米颗粒-蛋白冠(NPC)的表征
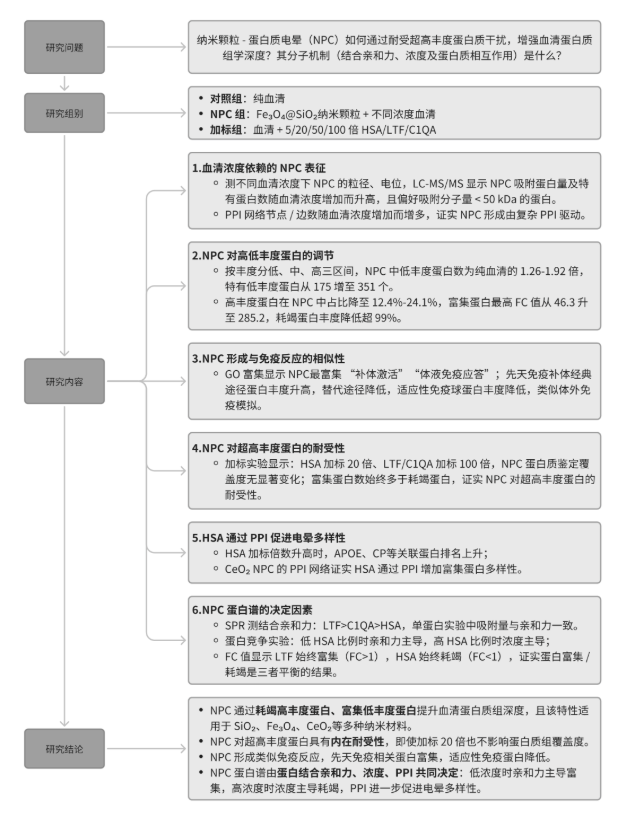
研究人员通过透射电子显微镜(TEM)和动态光散射(DLS)表征Fe₃O₄@SiO₂纳米颗粒(NPs),其直径约200nm(图1B)。系统研究血清浓度对NPC形成的影响发现,与血清孵育后,NPC水合直径从208nm增至281.5-298.3nm,zeta电位随血清浓度增加而升高(图1A-C-D)。
SDS-PAGE凝胶及灰度分析显示,NPC洗脱蛋白量随血清浓度增加而增加,但吸附量远低于血清总蛋白量(图1E)。蛋白质鉴定数量变化趋势与先前研究相似,且NPC特有蛋白数量呈血清浓度依赖性显著增加,NPC更易吸附分子量小于50 kDa的蛋白(图1F-G)。
基于STRING数据库构建的NPC蛋白PPI网络,节点和边数量随血清浓度增加而增加,表明网络复杂性与特有蛋白数量相关,NPC形成与复杂生物学PPI相关(图1H-I)。对比SiO₂、Fe₃O₄、CeO₂三种纳米材料的蛋白质组学,均表现出高丰度蛋白减少和低丰度蛋白增加的现象,且减少蛋白的均方误差(MSE)更高,说明蛋白耗竭对提升血清蛋白质组覆盖度更重要。
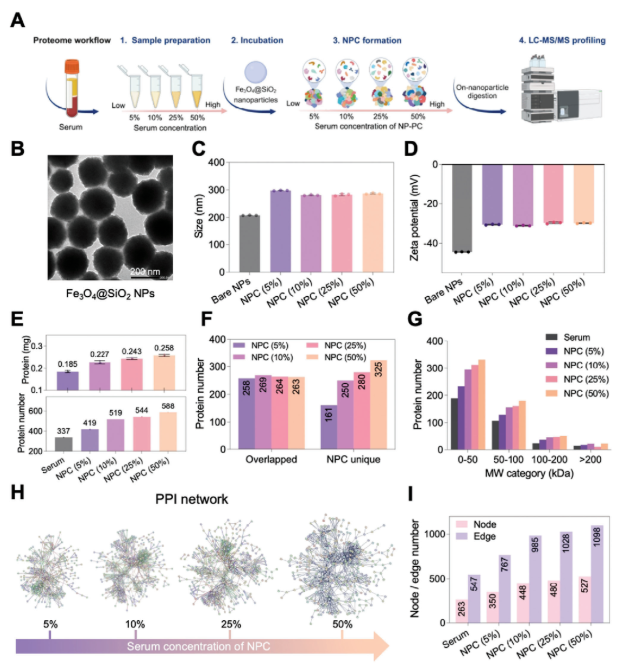
图1. 血清浓度依赖性Fe3O4@SiO2 NPC的形成和蛋白质组分析
2、富集低丰度蛋白、耗竭高丰度蛋白以提升蛋白质组学深度
研究人员将蛋白丰度分为低、中、高三区间,发现低丰度蛋白占血清和NPC中鉴定蛋白的大多数,且NPC中低丰度蛋白比例随血清浓度增加而升高,数量为纯血清的1.26-1.92倍,特有低丰度蛋白数量从175显著增至351(图2A-B)。
基于FC值将蛋白分为富集组(FC>1.2)和耗竭组(FC<0.83),富集蛋白最高FC值随血清浓度增加,如乳铁蛋白(LTF)、补体C1q亚组分A(C1QA)丰度持续升高(图2C-E);耗竭蛋白最低FC值为0.0001-0.001,人血清白蛋白作为血清中最丰富的蛋白,其在血清中的占比达52.0%,在NPC中则显著耗竭(图2F)。而NPC中最丰富蛋白占比随血清浓度增加从24.1%降至12.4%,且耗竭蛋白MSE值更高,表明蛋白耗竭主导蛋白质组覆盖度提升(图2G)。
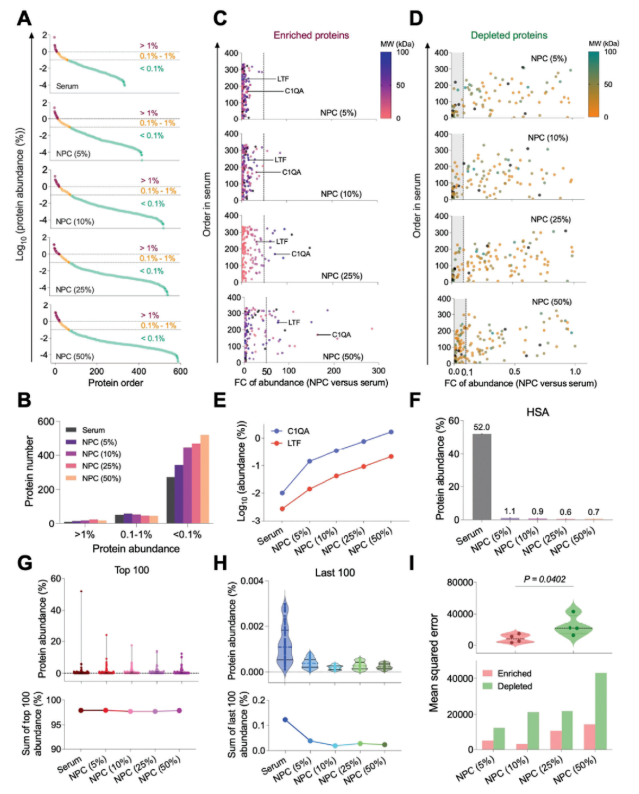
图2. Fe₃O₄@SiO₂ NPC通过富集低丰度蛋白、耗竭高丰度蛋白提升蛋白质组学深度
3、纳米颗粒-蛋白冠的形成模拟生物免疫应答
研究分析NPC形成中免疫相关蛋白变化及功能特征,证实其过程与生物免疫应答高度相似,具体如下:
免疫相关蛋白呈血清浓度依赖性变化:先天免疫中,体液免疫应答相关蛋白丰度随血清浓度升高而增加,适应性免疫相关蛋白(如免疫球蛋白)丰度则下降(图3A);先天免疫补体通路中,经典途径蛋白丰度升高、替代途径蛋白丰度降低、凝集素途径蛋白略有增加(图3B);脂质代谢相关蛋白中,APOE丰度升高,APOA1、APOB、APOC2、APOC3丰度降低(图 3C)。
功能分析显示,基于生物学过程(BP)分类,免疫相关蛋白占NPC总蛋白主要部分(图3D);5%血清NPC的GO富集分析中,最显著的生物学过程为“补体激活”和“体液免疫应答”(图3E)。
此外,SiO₂、Fe₃O₄、CeO₂三种纳米材料的NPC中,均鉴定到丰富的先天与适应性免疫相关蛋白,证实NPC形成模拟免疫应答的特征具有材料通用性。
图3. NPC免疫相关蛋白的分析
4、纳米颗粒-蛋白冠对超高丰度蛋白质的内在耐受性
为探究高丰度蛋白对NPC形成的影响,研究人员基于纯血清中人血清白蛋白(HSA,高丰度)、乳铁蛋白(LTF)和补体C1q亚组分A(C1QA)的基线浓度,进行蛋白加标实验。LC-MS/MS分析表明,即使HSA加标20倍、LTF和C1QA加标100倍,NPC的蛋白质鉴定覆盖度仍无显著变化(图4A-C),且HSA、LTF、C1QA的丰度与排名随加标倍数升高,高血清浓度仍能提升蛋白质组深度及特有蛋白富集量(图4D-F)。
分析不同加标条件下的富集与耗竭蛋白发现,富集蛋白数量远多于耗竭蛋白;HSA加标未显著改变两类蛋白数量,LTF和C1QA加标时,富集蛋白数量随血清浓度增加减少,耗竭蛋白数量增加(图4G-I),表明NPC对高丰度蛋白具有显著耐受性。
5、人血清白蛋白(HSA)通过蛋白质-蛋白质相互作用(PPI)促进蛋白冠多样性
HSA是血清中最丰富的蛋白,虽被认为干扰低丰度蛋白质谱鉴定,但其载体蛋白作用关键。研究发现,HSA加标倍数增加时,APOE、VTN等高丰度蛋白及CP、SHBG、HPX、SERPINA1等低丰度蛋白的排名均升高;而LTF和C1QA(非载体蛋白)仅少数相关蛋白因PPI随加标倍数升高排名(图4J-L)。HSA在NPC中占比<5%,表明其被显著减少而非完全耗竭;CeO₂ NPC的PPI网络进一步证实,HSA通过PPI显著促进富集蛋白冠的多样性。
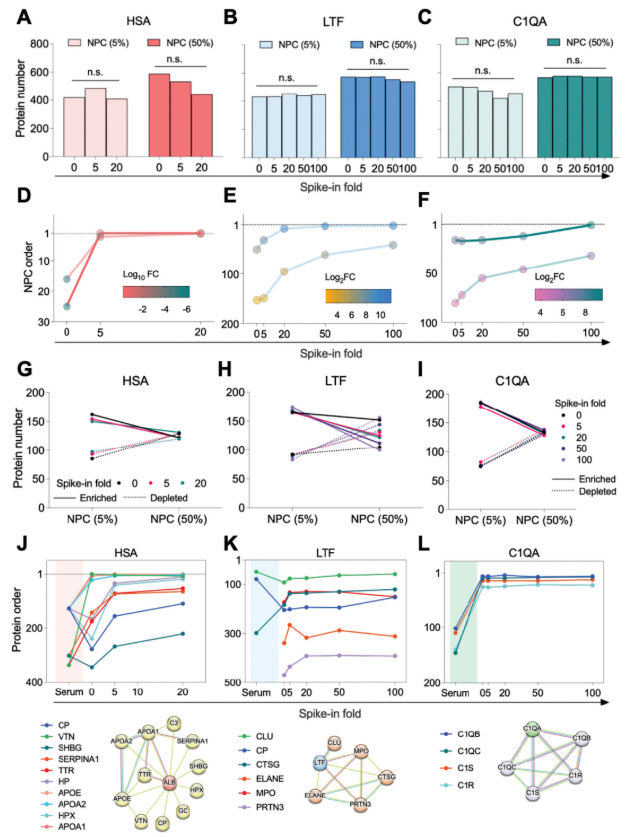
图4. 加标实验
6、结合亲和力、蛋白质浓度与PPI是蛋白冠谱的决定因素
通过表面等离子体共振(SPR)测定蛋白质与Fe₃O₄@SiO₂纳米颗粒的结合亲和力,顺序为LTF>C1QA>HSA;单蛋白实验中,吸附蛋白量的顺序与结合亲和力一致(LTF>C1QA>HSA),表明结合亲和力决定蛋白质在纳米颗粒表面的吸附(图5A-C)。
蛋白竞争模型结果显示:低HSA比例时,结合亲和力主导NPC形成,SDS-PAGE凝胶中LTF和C1QA条带明显;高HSA比例时,蛋白质浓度主导NPC形成,HSA条带显著突出;且吸附蛋白的质量随HSA比例增加先逐渐下降,随后达到稳定状态(图5D-E)。
归一化光谱计数(NSpC)分析表明,当HSA:LTF:C1QA为1:1:1时,LTF的NSpC占比高达 90.34%;随着HSA输入比例增至99.7%(625:1:1),其NSpC占比显著增加,而LTF和C1QA的NSpC占比则明显降低(图5F)。进一步通过倍数变化(FC)值分析蛋白富集或耗竭状态:LTF始终为富集蛋白(FC>1),HSA始终为耗竭蛋白(FC<1),C1QA在三蛋白模型中表现为耗竭蛋白(图5G-I)。
综上,蛋白质的富集或耗竭是结合亲和力、蛋白质浓度与PPI三者平衡的结果:高结合亲和力的蛋白质在低浓度条件下通常被富集,而低结合亲和力的蛋白质在高浓度条件下通常被耗竭。
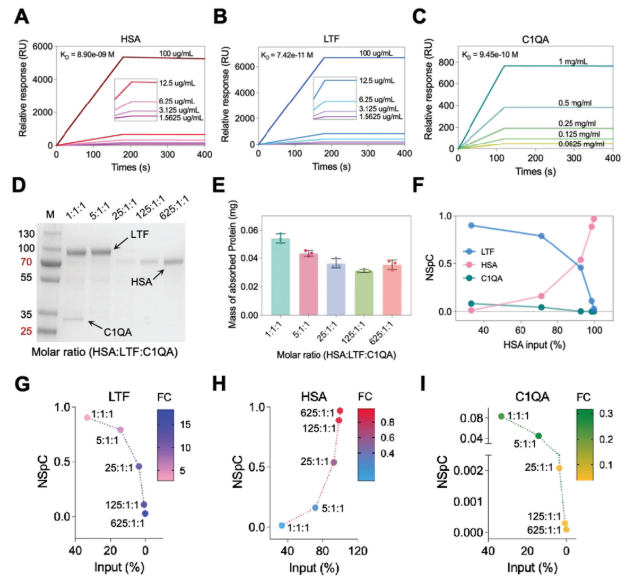
图5. 蛋白质竞争揭示了不同结合亲和力的蛋白质具有不同的结合模式
研究结论
本研究围绕纳米颗粒-蛋白冠(NPC)展开,通过蛋白质加标实验、三蛋白实验结合LC-MS/MS、SPR等技术,系统探究NPC增强血清蛋白质组学深度的机制。结果表明,NPC具有三大核心特性:一是呈血清浓度依赖性提升蛋白质组覆盖度,通过耗竭高丰度蛋白质、富集低丰度蛋白质实现深度蛋白质组学;二是对血清中超高丰度蛋白质具有极强内在耐受性,即使HSA加标20倍、低丰度蛋白LTF/C1QA加标100倍,NPC的蛋白质鉴定覆盖度仍无显著变化;三是其形成由蛋白质结合亲和力、蛋白质浓度与蛋白质-蛋白质相互作用三者动态平衡决定——低浓度时亲和力主导吸附,高浓度时浓度主导,PPI则辅助调控蛋白组成。该研究为NPC在疾病生物标志物发现、精准诊断中的应用提供了关键理论支撑。
血液蛋白冠-DIA 1X:以纳米材料表面修饰技术为核心支撑,通过纳米颗粒与血清/血浆样本的特异性共孵育反应,依托分子间特异性亲和力实现低丰度蛋白的高效富集,进而形成蛋白冠结构。该技术整合样本前处理自动化平台,耦合高灵敏度Astral质谱系统,采用数据非依赖采集(DIA)模式,可实现血液样本的深度蛋白质组学全景分析。相较于常规血液蛋白质组学检测方案,该技术的核心优势在于搭载自主研发的专利磁珠D1(已获国家专利认证)。从磁珠的精密制备到标准化应用流程,均由专业设备与技术团队全程质控,确保磁珠批次间稳定性与均一性。基于此,检测数据呈现出卓越的质量特征:蛋白鉴定数量稳定突破5000+,蛋白稳定检出率达80%以上,同时显著提升功能性指标的检出丰度,为血液蛋白质组学研究提供了高维度、高可靠性的技术解决方案。