
英文标题:ACSL4-Mediated Membrane Phospholipid Remodeling Induces Integrin β1 Activation to Facilitate Triple-Negative Breast Cancer Metastasis
中文标题:ACSL4介导的膜磷脂重塑诱导整合素β1激活以促进三阴性乳腺癌转移
发表期刊:Cancer Research
影响因子:16.6
客户单位:重庆医科大学
百趣提供服务:定量脂质组学、经典脂质组学
研究背景
乳腺癌是女性常见癌症,具有显著异质性。三阴性乳腺癌(Triple-Negative Breast Cancer, TNBC)占所有乳腺癌病例的12%~17%,缺乏雌激素受体(Estrogen Receptor, ER)、黄体酮受体(Progesterone Receptor, PR)和HER2,预后较差,复发和转移率高。脂质代谢异常可促进肿瘤转移,但其在TNBC中的具体机制尚不清楚。本研究发现,转移性TNBC细胞中ACSL4异常上调,与不良预后和转移相关。ACSL4通过催化PUFA生成PUFA-CoA并将其酯化为磷脂,增加磷脂不饱和度,改变膜生物物理性质,促进脂筏中整合素β1和CD47的富集与相互作用,激活整合素β1/FAK信号通路,促进TNBC转移。此外,ACSL4抑制剂PRGL493联合紫杉醇和顺铂可显著抑制TNBC生长和转移,为TNBC治疗提供了新策略。
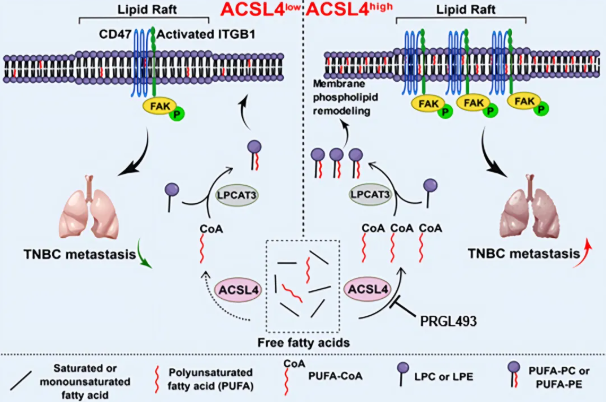
ACSL4调控机制和靶向治疗示意图
研究结果
2.1 在转移性TNBC肿瘤中,磷脂不饱和度升高
为了确定转移性TNBC肿瘤的脂质谱,研究人员采用 LC/MS-MS脂质组学分析,检测了NCG小鼠肝脏中四对原发性和转移性肿瘤组织中的脂质代谢物变化。共鉴定出785种脂质代谢物,其中71种在转移瘤中显著增加,70种显著减少。磷脂酰胆碱(Phosphatidylcholine, PC)和磷脂酰乙醇胺(Phosphatidylethanolamine, PE)是转移瘤中变化最显著的主要脂质(图1A-C)。进一步分析发现,与原发肿瘤相比,转移性肿瘤中多不饱和磷脂(PUFA-containing Phospholipids, PUFA-PL)的丰度显著升高,而饱和脂肪酸磷脂(saturated fatty acid-containing phospholipids, SFA-PL)和单不饱和脂肪酸磷脂(monounsaturated fatty acid-containing phospholipids, MUFA-PL)的丰度显著降低。转移性肿瘤倾向于产生更多含有4个或更多不饱和键的总磷脂、PE和PC,且在sn-2位置的多不饱和脂肪酰基链(18–22碳)更丰富(图1D-H)。这些结果表明,含有长链多不饱和脂肪酸(long-chain PUFAs, LC-PUFA)的磷脂是转移性TNBC的代谢特征。
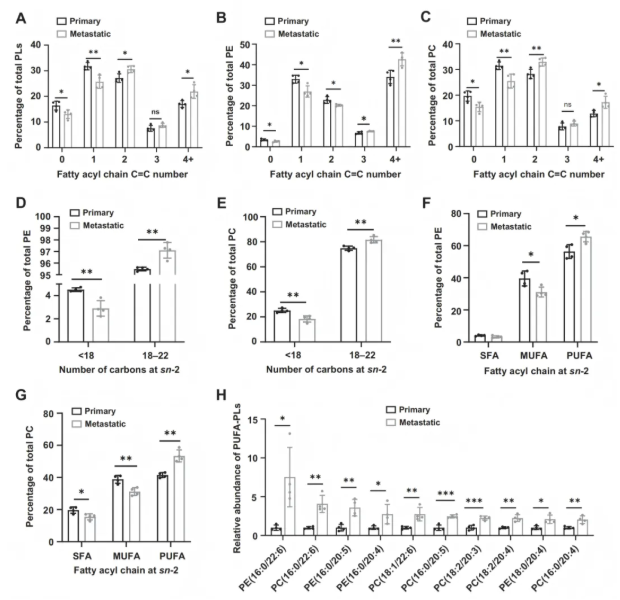
图1. 在转移性TNBC肿瘤中,磷脂不饱和度升高
2.2 ACSL4升高与TNBC预后不良相关,并有助于转移
TNBC相较于ER阳性乳腺癌(ER+BC)具有更高的转移倾向,且其肿瘤细胞中富含多不饱和磷脂(PL-PUFAs),而ER+BC则富含单不饱和磷脂(PL-MUFAs)。这提示TNBC存在独特的磷脂重塑现象,可能促进肿瘤转移。为了探索TNBC细胞中调节 PUFA-磷脂重塑的关键酶,作者通过分析数据集 METABRIC,发现ACSL4等基因在TNBC中与磷脂重塑相关,且ACSL4在TNBC细胞中表达上调。研究人员通过免疫组化染色评估了30例TNBC患者配对肿瘤和正常组织中ACSL4蛋白水平,发现TNBC组织中ACSL4蛋白染色更强(图2A-B)。在包含95例腔内乳腺癌、34例HER2阳性乳腺癌和31例TNBC患者的组织微阵列芯片(Tissue Microarrays, TMA)中,TNBC的ACSL4 IHC评分高于其他亚型(图2C-D)。Kaplan-Meier生存分析显示,ACSL4高水平与乳腺癌患者的N期和较差总生存期显著相关(图2E-F)。ACSL4表达与远处转移相关,转移性TNBC患者的原发肿瘤中ACSL4 mRNA水平更高(图2G-H)。ACSL4表达与远端无转移生存率呈负相关。在 NCG小鼠模型中,与原发肿瘤相比,肺和肝转移瘤中ACSL4水平更高。ACSL4敲低损害了TNBC细胞的迁移和侵袭能力,而异位ACSL4则恢复了这些能力。在NCG小鼠模型中,MDA-MB-231中ACSL4的缺失显著诱导CTC凋亡,降低肺和肝脏的转移负担,并减少转移灶中Ki-67阳性细胞(图2J-O)。这些结果表明ACSL4是TNBC转移的关键因素,可作为恶性TNBC的生物标志物。
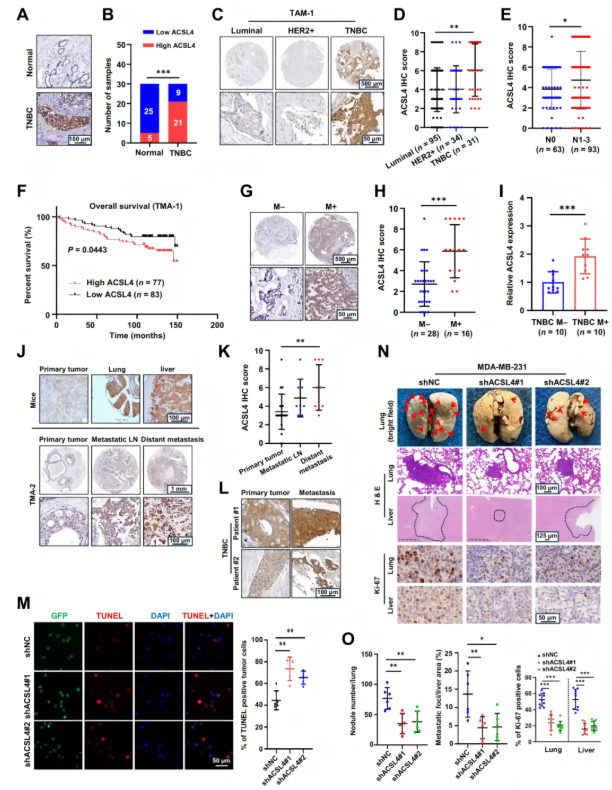
图2. ACSL4增强与TNBC预后不良相关,并促进转移
2.3 ACSL4促进TNBC细胞中PUFA-PLs的产生
为了揭示ACSL4在TNBC细胞中对PUFA-PLs生成的调控机制,研究人员通过实验发现ACSL4在TNBC细胞中通过促进多不饱和脂肪酰基磷脂(PUFA-PLs)的生成来调节细胞膜磷脂组成(图3A),并影响TNBC细胞的转移能力。研究发现,ACSL4缺失导致PUFA-CoA减少,SFA-CoA和MUFA-CoA增加,同时PUFA-PLs(如PUFA-PC和PUFA-PE)也减少。ACSL4敲低的细胞中,饱和程度为4的磷脂(包括PE和PC)百分比降低,而饱和程度为1的磷脂百分比增加。此外,ACSL4敲除显著降低了特定LC-PUFA-PLs(如PE(18:0/20:4)和PE(16:0/20:4))的水平(图3C-D)。这些变化导致细胞膜流动性降低,表明ACSL4对TNBC细胞膜磷脂组成和生物学特性有显著影响(图3E-G)。另外,研究还证明,ACSL4介导的PUFA-PLs变化影响TNBC转移。实验中,ACSL4敲低的肿瘤细胞分别用SFA-PE、MUFA-PE和PUFA-PL处理后,外源性PAPE脂质体显著恢复了细胞的侵袭能力和失巢凋亡抵抗,并增加了转移负荷及Ki-67阳性细胞数量(图3H-K)。PAPE未显著降解为AA或LPA,且PLA2抑制剂giripladib不影响PAPE处理后的细胞侵袭和失巢凋亡抗性,表明PAPE本身而非其代谢物在ACSL4沉默的乳腺癌细胞中起代偿作用。ACSL4通过调节膜磷脂组成和不饱和度,促进乳腺癌细胞的侵袭、抗凋亡和转移性生长。
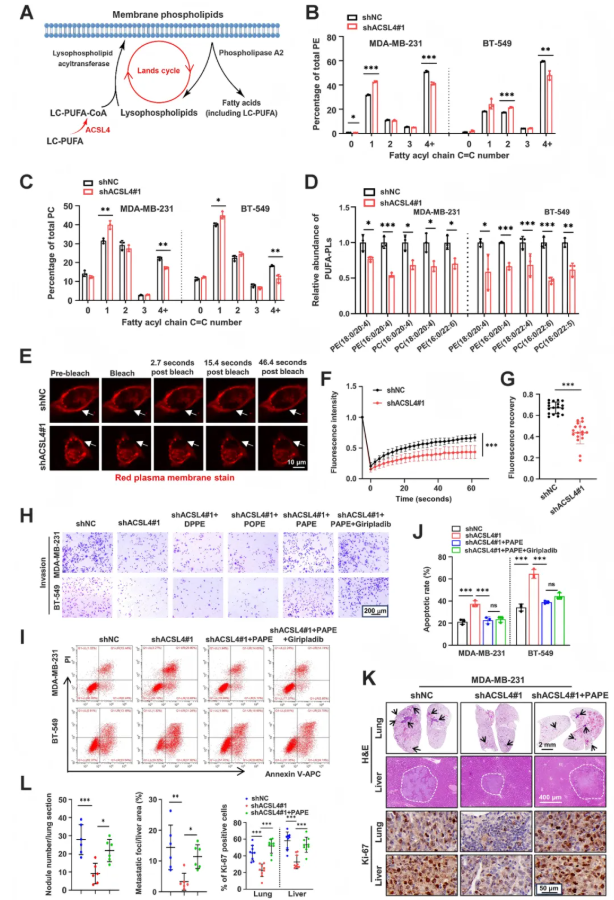
图3. ACSL4促进TNBC细胞PUFA-PL的产生
2.4 磷脂重塑促进了ITGB1和CD47在脂筏中的定位和相互作用
为了探究ACSL4介导的细胞转移机制,研究人员分析了ACSL4相关的信号网络,对乳腺癌肿瘤中的基因表达谱(来自TCGA数据库)进行分析发现ACSL4表达与肿瘤转移相关的信号通路存在相关性,例如细胞外基质-受体相互作用和黏着斑形成。研究表明,膜磷脂饱和度会影响脂筏中受体的定位和激活,而ACSL4介导的磷脂不饱和可能激活脂筏中的促转移信号分子,进而促进转移相关信号通路。实验显示,ACSL4敲除后,脂筏中的CD47和ITGB1蛋白水平显著降低,而外源性PAPE脂质体处理可恢复其水平(图4A-E)。此外,ACSL4敲除削弱了CD47与ITGB1的相互作用,而PAPE脂质体处理可部分挽救这种相互作用,但脂筏抑制剂MβCD可阻断该效应(图4G)。这些结果表明,ACSL4介导的磷脂重塑通过调节CD47和ITGB1在脂筏中的定位和相互作用,促进了TNBC细胞的转移能力。
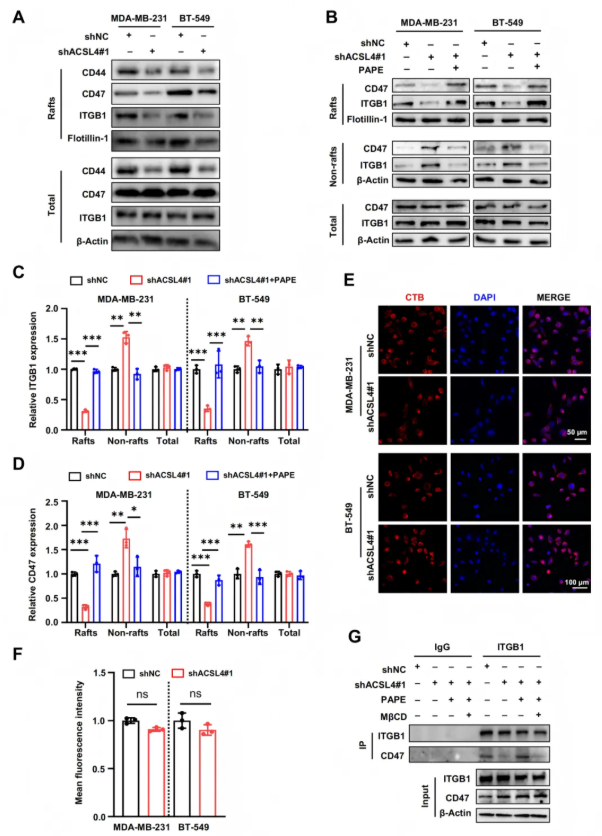
图4. 磷脂重塑促进了ITGB1和CD47在脂筏中的定位和相互作用
2.5 CD47对于不饱和磷脂介导的整合素β1/FAK信号的激活至关重要
为了探讨ACSL4介导的膜磷脂重塑对整合素β1(ITGB1)活性及其下游FAK信号通路的影响。通过结果表明,ACSL4缺失减少了活化整合素β1(Act-ITGB1)在脂筏中的定位和蛋白水平,但外源性PAPE脂质体处理可恢复其水平(图5A-D)。PAPE处理还增强了pFAK水平,激活了FAK信号通路,促进了细胞侵袭和抗失巢凋亡,而这些效应可被CAV1沉默或FAK抑制剂defactinib阻断。此外,CD47是整合素β1/FAK信号激活和细胞侵袭的关键因子,ACSL4缺失降低了Act-ITGB1与CD47的共定位,而PAPE处理可恢复这种共定位,但CD47沉默会削弱PAPE的恢复作用(图5E-J)。体内实验进一步证实,高表达ACSL4的TNBC肿瘤中,Act-ITGB1在脂筏中的定位增强,且FAK信号激活显著增加。这些结果表明,ACSL4通过膜磷脂重塑影响整合素β1的脂筏定位和活性,进而激活FAK信号通路,促进TNBC细胞侵袭,而CD47在这一过程中发挥重要作用。
为了证明体内ACSL4表达与ITGB1/FAK信号激活之间的关联,研究人员分析了TNBC肿瘤组织中ACSL4、ITGB1和pFAK蛋白水平。高表达ACSL4的肿瘤增强了Act-ITGB1在脂筏中的表达和定位(图6A-B),这与FAK信号激活增加显著相关(图6C-D)。
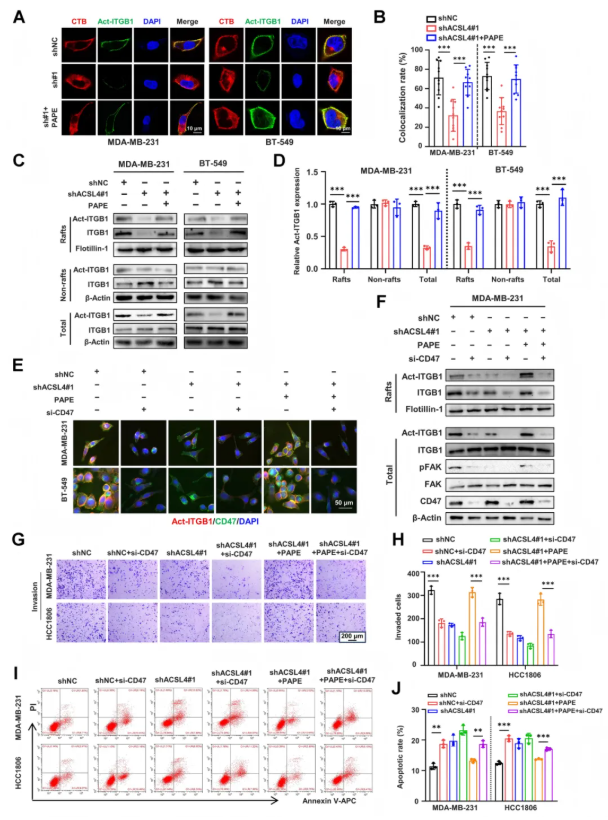
图5. CD47对于不饱和磷脂介导的整合素β1/FAK信号的激活至关重要
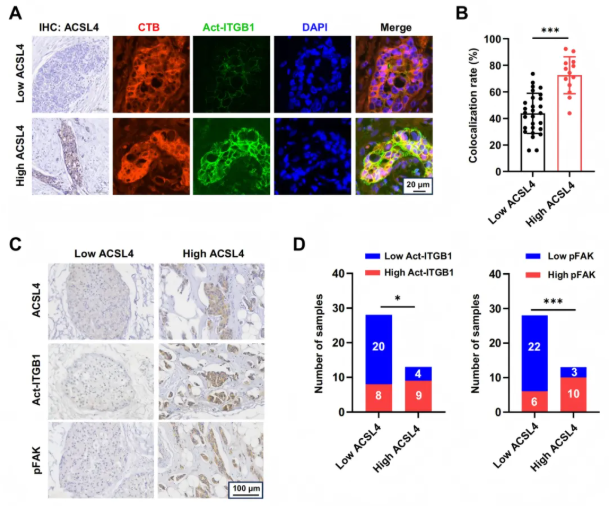
图6. 在TNBC样本中,ACSL4表达水平与ITGB1和FAK激活状态呈正相关
2.6 靶向ACSL4增加TNBC对化疗的敏感性,抑制TNBC的生长和转移
为了评估靶向ACSL4在TNBC治疗中的潜在价值。实验结果显示,ACSL4低表达的TNBC患者对紫杉醇(PAC)治疗更敏感,而高表达者则表现为耐药(图 7A-C)。在40例接受紫杉醇治疗的患者中,耐药肿瘤的ACSL4蛋白水平显著更高。进一步的体内实验表明,ACSL4抑制剂PRGL493联合紫杉醇和顺铂(Cisp)治疗显著抑制了TNBC小鼠模型的肿瘤生长和转移,效果优于单独或两药联合治疗(图7D-J)。此外,PRGL493单独处理可缩小对照TNBC细胞的肿瘤体积,但对ACSL4缺陷细胞无影响,并且治疗未引起小鼠体重的明显变化。机制上,PRGL493处理降低了肿瘤细胞中含LC-PUFAs的磷脂水平。这些结果表明,靶向ACSL4可增强TNBC对化疗的敏感性。
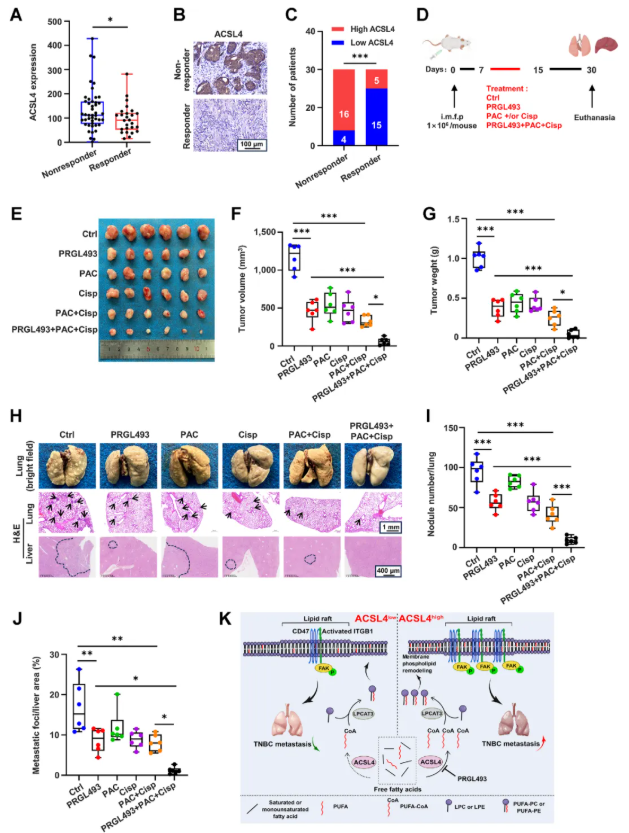
图7. 靶向ACSL4可增加TNBC对化疗的敏感性并抑制其生长和转移
研究结论
TNBC患者预后差,因其侵袭性和高转移性,且缺乏有效治疗靶点。研究发现,转移性TNBC细胞中磷脂不饱和度显著增加,ACSL4(长链酰基辅酶A合成酶4)上调,驱动PUFA掺入磷脂,导致膜磷脂重塑。ACSL4介导的磷脂重塑促进脂筏中整合素β1和CD47的富集及相互作用,激活整合素β1/FAK信号通路,促进TNBC转移(图7)。靶向ACSL4可增强TNBC对化疗的敏感性,为TNBC治疗提供新策略。脂筏在ACSL4介导的信号传导中起关键作用,促进整合素β1与CD47的相互作用和信号激活。CD47对整合素β1功能至关重要,其缺失会削弱ACSL4介导的FAK磷酸化和TNBC的侵袭及抗失巢凋亡能力。此外,联合使用ACSL4抑制剂PRGL493、紫杉醇和顺铂可显著抑制TNBC生长和转移,表明靶向ACSL4可增强化疗效果。综上所述,ACSL4介导的磷脂重塑是TNBC转移的关键机制,靶向ACSL4有望成为TNBC治疗的新靶点,改善患者预后。
百趣生物定量脂质组学:是一款专注于脂质精准定量的靶标代谢组学产品,旨在为医学、农林、中医药、食品等领域的科研及产业需求提供高覆盖、高精准的脂质分析解决方案。作为公司主打产品,其通过自建超大脂质数据库、同位素内标一对一校正、双色谱柱(C18+HILIC)采集体系及三维严格质控,实现 “多、准、稳” 的检测优势,助力生物标志物发现、病理机制研究、作物品质改良等多场景应用。
百趣生物经典脂质组学:对生物体、组织或细胞中的脂质以及与其相互作用的分子进行全面系统的分析、鉴定,了解脂质的结构和功能,进而揭示脂质代谢与细胞、器官乃至机体的生理、病理过程之间的关系。目前脂质组学已经被广泛运用于药物研发、分子生理学、分子病理学、功能基因组学、营养学以及环境与健康等重要领域。