
随着代谢组学研究的深入,复杂生物样本中低丰度代谢物与外源化合物的精准鉴定已成为推动疾病机制研究和生物标志物发现的关键。然而,传统质谱技术在检测灵敏度、扫描速度与数据解析能力方面仍存在局限,限制了其在全局代谢物覆盖与高置信度注释方面的应用。近年来,Orbitrap Astral质谱仪的推出,以其超高灵敏度、快速MS/MS采集速度和高分辨率性能,为代谢组学研究带来了前所未有的技术突破。本文分享两篇基于Astral的研究,分别从谱图去噪与结构引导网络注释两个维度,系统阐述Astral仪器在提升代谢物鉴定数量、质量与效率方面的显著优势。
文章一

英文标题:Denoising Search doubles the number of metabolite and exposome annotations in human plasma using an Orbitrap Astral mass spectrometer
发表期刊:nature methods
影响因子:32.1
研究背景
化学暴露可能影响人类代谢,并导致阿尔茨海默病(Alzheimer’s Disease, AD)等神经退行性疾病的发生。这些外源化合物和活性代谢物在体内通常浓度极低,并且噪声离子的存在会显著降低质谱质量,导致假阴性和识别率下降。为应对这一挑战,Spectral Denoising算法应运而生。在对240种测试代谢物的基准研究中,质谱去噪表现优于其他方法。对于在Orbitrap Astral质谱仪上分析的AD患者血浆样本,Denoising Search检测到的注释化合物数量是Exploris 240 Orbitrap仪器的2.3倍,包括药物代谢物、家庭和工业化学品以及农药。这种先进仪器与优越去噪算法的结合,为精准医学在暴露组学研究中的应用开辟了新的道路。
研究结果
1、Spectral Denoising算法的高效性与可靠性
图1展示了Spectral Denoising算法如何去除在碰撞诱导的MS/MS谱图中记录的、不代表前体离子真实碎片的离子。在电子去噪有效性验证中,一个用于精准识别并移除“草状”电子噪声的阈值被确立,成功保留了低丰度的真实碎片离子,使得在不影响信息完整性的前提下显著提升了信号信噪比(图1a)。对于化学去噪的准确性,该算法通过计算碎片离子的精确质量与母离子间的“化学上合理丢失”来识别化学噪声(图1c);同时,分子式信息可以从参考质谱库(如NIST23、MassBank.us或GNPS)的匹配结果中检索到,也可以使用化学信息学工具计算出来(图1b)。当将电子与化学去噪步骤整合后,在1万条NIST23谱图上进行了大规模验证。结果表明,去噪后的谱图与原始高质量谱图的MS/MS熵相似度平均值高达0.99以上。因此,Spectral Denoising在大规模数据处理中,既能高效去除噪声,又几乎不损失任何真实碎片信息,确保了谱图匹配的高准确度。
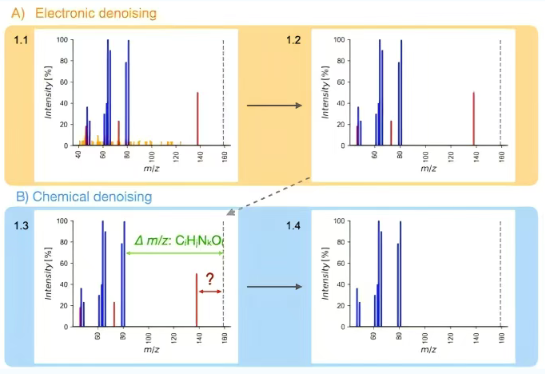
图1 Spectral Denoising流程图
2、对在500-0.02 pmol进样量范围内的质谱图进行去噪
为评估去噪算法区分噪声离子和真实碎片离子的能力,“解释离子强度”被用以量化每个谱图中真实离子强度的比例(图2a)。在质谱熵相似度的概率分布图中(图2b),随着进样量的降低,中位质谱匹配相似度也显著下降。当进样量为1 pmol时,超过65%的MS/MS谱图在质谱熵相似度大于0.75的阈值下无法匹配参考谱图(图2b)。重要的是,Spectral Denoising算法对于所有测试化合物都有效地去除了化学和电子噪声离子(图2c),即使是在200 pmol进样时,仍有25%的化合物显示出0.05的质谱熵相似度增益(图2c)。在相关示例谱图,经过Spectral Denoising后的亚精胺谱图实现了完美的匹配,质谱熵相似度达到0.95(图2d)。
为评估Spectral Denoising的效率,三种主要的MS/MS去噪技术(1% bp thresholding法、DNL denoising法、MS Reduce法)被用于基准测试。相比之下,Spectral Denoising方法在质谱匹配上取得了实质性的增益,中位数质谱熵相似度、谱图的匹配相似度、化合物注释率均得到有效提升(图2e)。
此外,与在未处理的原始MS/MS谱图中达到>0.75相似度所需的最低进样量比较,经过Spectral Denoising处理后所需的最低进样量之间的倍数变化如图2f所示。结果显示,其他方法不仅效果微乎其微,甚至会因错误移除真实碎片离子而导致假阴性,损害数据质量;相比之下,Spectral Denoising方法将上样所需的摩尔量降低了35倍,且没有一种化合物在去噪后出现假阴性。
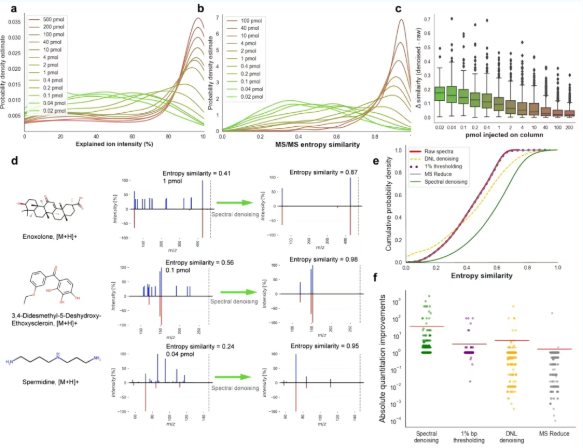
图2 Spectral Denoising算法的开发、验证与基准测试
3、Spectral Denoising技术在去除人工噪声离子的应用
为验证Spectral Denoising在复杂样本中面对化学噪声和电子噪声时的稳定性,九种不同污染水平的人工嵌合谱图被构建,并与现有的主流方法(1% bp thresholding法、DNL denoising法、MS Reduce法)进行了对比测试(图3)。结果表明,在所有九种噪声污染场景下,Spectral Denoising能将受污染谱图的中位数熵相似度从添加噪声后的约0.5,有效恢复至接近原始谱图的0.8水平,显著优于其他方法。相比之下,MS Reduce、DNL denoising和1% bp thresholding方法不仅效果有限,甚至在某些情况下会损害谱图匹配质量。此外,Spectral Denoising在应对不同组合的化学和电子噪声时表现出极高的稳定性,无论噪声是来自高丰度的化学干扰物,还是低强度但广泛的电子“草状噪声”,该算法都能有效识别并去除,从而恢复谱图的核心特征。有趣的是,对于碎片离子少、熵值低的谱图,Spectral Denoising的提升效果最为显著,匹配质量更稳定(图4)。综上,Spectral Denoising较其他技术的表现更佳,并且在不同水平的化学和电子噪声污染下都极其稳健;当处理代谢组学中常见的稀疏碎片谱图时,其底层假设更准确,因此性能更优越,是更为可靠的选择。
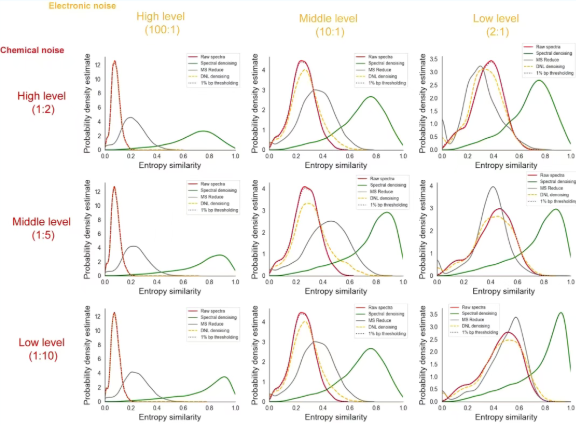
图 3 在不同水平的人为添加的化学和电子噪声下,应用三种质谱去噪算法基准方法前后的MS/MS熵相似度的概率分布
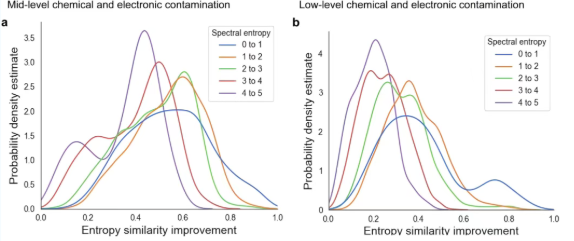
图 4 以500 pmoL谱图为参照物,对240个进样标准谱在0.02-200 pmoL范围内的所有MS/MS谱图进行去噪处理后,改进MS/MS相似度的密度分布
4、去噪搜索技术在阿尔茨海默病血浆样本的质谱/质谱数据分析中的应用
与Exploris的原始MS/MS谱图相比,Denoising Search在Astral数据上导致了2.5倍的注释增加,其中包括许多在Exploris Orbitrap仪器上未发现的暴露组化合物(图5a)。另外,在一台个人笔记本电脑上,Denoising Search搜索包含200万谱图的复合参考库,平均处理时间仅为100毫秒/谱图。值得注意的是,对于原始熵相似度≥0.4的Astral谱图,使用Denoising Search后,其MS/MS熵相似度的中位数提升了0.1(图5b)。当对七个主要ClassyFire化合物超类的进一步分析时,相较Exploris仪器,Denoising Search在Astral谱图上注释的化合物数量在所有超类中均显著增加(图5c)。
基于Astral Orbitrap质谱仪的高灵敏度和前所未有的采集速度,让其与Denoising Search的强去噪能力结合,成功鉴定出人类血液中未被充分研究的几种化合物(图5d)。此外,通过准确质量与MS/MS匹配,还首次鉴定出了受阻酚抗氧化剂Irganox 565(图5d)。这一发现不仅填补了该物质在人体暴露研究中的空白,也证明了该方法在发现新生物标志物和环境污染物方面的强大潜力。
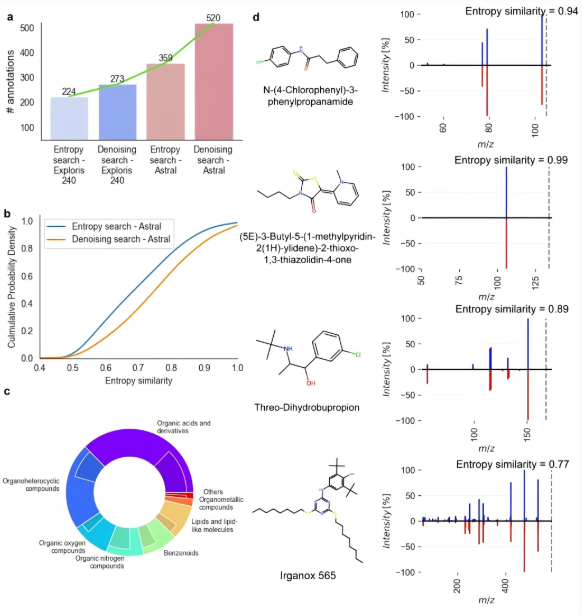
图 5 在Exploris 240 Orbitrap仪器和Astral质谱仪上,对20名阿尔茨海默病患者血浆样本进行正离子ESI模式疏水作用LC-MS/MS分析的Denoising Search结果
研究小结
本研究核心在于开发并验证了Denoising Search算法,其涉及Spectral Denoising算法与谱图搜索流程的整合,是一种针对代谢组学和暴露组学中低丰度化合物谱图去噪的有效策略。其中,Spectral Denoising算法通过结合强度建模和子公式分配,能够有效去除噪声离子,同时保留真实的碎片离子,显著提升了MS/MS熵相似度。此外,Spectral Denoising在与多种替代去噪算法的基准测试中持续表现出色,不仅提升了熵相似度,还提高了高置信度注释的绝对数量限值,其性能在不同噪声水平下保持稳定。当Denoising Search应用于最新的Astral质谱仪时,相比经典Exploris 240质谱仪的常规方法,其能够注释的化合物数量提升了2.5倍,且效果覆盖所有主要化学超类。未来该方案可结合保留时间匹配、分子横截面比较等正交实验手段,以进一步提高化合物注释的置信。总而言之,Denoising Search是一种强大的工具,有望显著提升代谢组学和暴露组学研究的覆盖广度和深度。
尽管Denoising Search通过提升谱图质量显著增强了代谢物鉴定的准确性,但在复杂生物样本中,如何系统性地构建代谢物网络并实现高覆盖注释仍是另一大挑战。Astral仪器不仅为去噪算法提供了高质量原始数据,其高速度、高灵敏的MS/MS采集能力也为结构引导的网络注释方法带来了新的可能。下文将介绍一项基于Astral平台的增强型结构引导分子网络(E-SGMN)研究,进一步展示Astral在提升注释规模与准确性方面的综合优势。
文章二

英文标题:Enhanced Structure-guided Molecular Networking Annotation Method for Untargeted Metabolomics Data from Orbitrap Astral Mass Spectrometer
发表期刊:analyical chemistry
影响因子:6.7
研究背景
复杂样品中化合物的快速、高效和准确注释仍是代谢组学中的一个重大挑战。最近开发的Orbitrap Astral质谱仪将传统的四极杆Orbitrap与新型Astral质量分析器相结合,提供了快速的MS/MS扫描速度和高灵敏度。然而,现有的代谢组学注释方法尚未充分利用 Astral MS的先进能力。本研究提出了一种增强型结构引导分子网络(Enhanced Structure-Guided Molecular Networking, E-SGMN)方法。E-SGMN通过准确地提高网络规模来扩大标注覆盖范围,同时最大限度地减少不相关化合物的包含,实现标注规模和准确性之间的平衡。该方法不仅增强了注释覆盖率,而且为理解复杂的生物系统提供了一种变革性的工具,在生命科学和临床医学方面具有巨大的潜力。
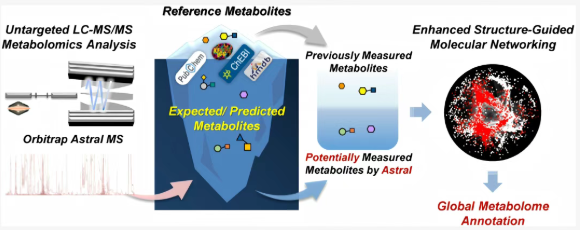
研究结果
1、方法工作流程
所提出的策略包括三个步骤(图1)。首先,使用Orbitrap Astral质谱仪获取大量非靶标LC-MS/MS代谢组学数据。其次,开发了增强的结构引导分子网络(E-SGMN)来改进代谢物注释。最后,E-SGMN用于代谢物注释。在彻底评估tR和精确质量容差对注释性能的影响后,确定了tR为30%和精确质量为10 ppm的最佳容差。与基于SGMN的注释类似,E-SGMN利用基于网络的传播,通过整合tR、MS1和谱图相似性来实现全面和准确的代谢物注释。这种基于E-SGMN的注释方法扩展了代谢物覆盖范围,同时最大限度地减少了冗余分子条目,确保了注释覆盖范围和准确性之间的平衡。
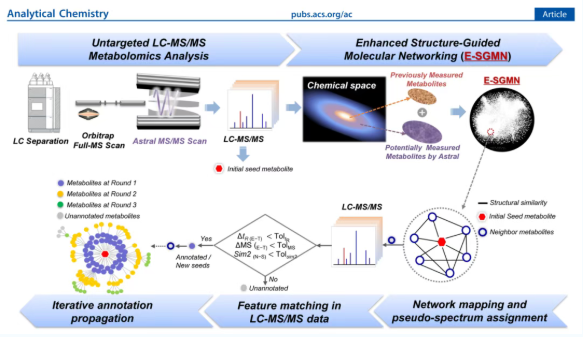
图1. 使用Orbitrap Astral MS和增强的结构引导分子网络(E-SGMN)进行全球代谢组注释的工作流程
2、高效准确地构建E-SGMN
本研究构建了五个不同组成和大小的分子网络(四个SGMN和一个E-SGMN),每个网络都包含所有850种标准代谢物。如图2a所示,MN1-1(SGMN)代表一个血液特异性网络,包含来自内部数据库OSI/SMMS的432种和来自HMDB的4466种血液中检测到的内源性代谢物。MN2(SGMN)是一个代谢物驱动的网络,由来自KEGG的7236种代谢物与OSI/SMMS整合而成。MN3-1(SGMN)是一个血液-代谢物混合网络,由MN1-1和MN2合并而成,包含10,305种代谢物。MN4(SGMN)是一个泛生物样本网络,包含17,633种代谢物,通过进一步整合HMDB的所有检测到的内源性代谢物而构建。MN5(E-SGMN)是通过在MN4的基础上增加来自HMDB的3948种预期/预测内源性代谢物而构建的,这些代谢物通过来自五个典型生物样品的Orbitrap Astral LC-MS数据进行过滤,从而形成了一个包含21,581种代谢物的综合数据集(表1)。这些网络表现出良好的连接性、强鲁棒性和高重复性,并且对于非靶代谢组学数据中可靠的网络传播注释至关重要。
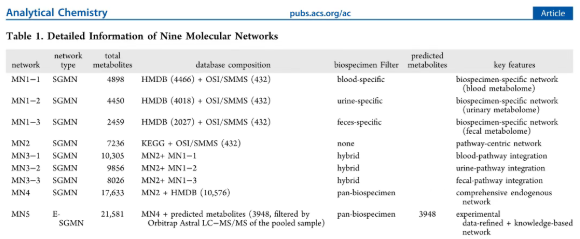
表1. 九种分子网络的详细信息
本研究基于五个MNs,分析了模拟加标血浆样品数据集,并评估了注释规模、覆盖率和准确性。如图2b所示,随着网络大小从4,898增加到21,581,注释的加标标准品数量从568缓慢增加到704。注释覆盖率从66.82%增加到82.82%,而注释准确率从90.14%下降到80.54%。值得注意的是,准确注释的数量没有继续增长。表明在理想条件下,较大的MNs并不能有效提高加标标准品的注释性能。基于不同的MNs,血浆中注释的代谢物数量从718增加到2299。由于血浆中的注释特征也同步增加,这表明将网络大小从MN1-1扩展到MN5对于注释真实生物样品是有效的。值得注意的是,血液特异性网络(MN1-1)和血液-代谢物混合网络(MN3-1)产生的注释明显少于MN4和MN5,进一步证明了知识数据库中的可靠证据代谢物忽略了使用最先进技术Orbitrap Astral容易检测到的代谢物。
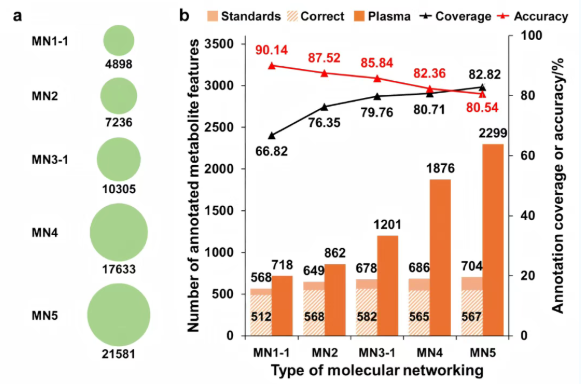
图2. 背景网络的来源和大小对RPLC-ESI+-Astral中模拟尖峰NIST SRM 1950人血浆注释性能的影响
3、方法验证
在加标的标准代谢物中,在Orbitrap Astral和QE HF中检测到95个加标标准品的MS/MS谱,以直接比较注释性能。SGMN-QE HF和E-SGMN-Astral分别注释了69.47%和76.84%的加标标准品(图3a)。此外,SGMN-QE HF和E-SGMN-Astral分别正确鉴定了71.21%和78.08%的注释标准品(图3a)。其中,与SGMN-QE HF相比,E-SGMN-Astral注释了10种额外的代谢物,无假阳性。相比之下,与E-SGMN-Astral相比,SGMN-QE HF仅注释了3种额外的代谢物,但所有注释都不正确。这些结果表明E-SGMN-Astral在保持高准确性的同时提高了注释性能。
4、与其他注释方法的比较
第一种注释方法涉及将MS1、MS/MS和保留时间(tR)与1384种市售标准代谢物进行匹配,第二种方法使用MS1和MS/MS与参考光谱数据库进行匹配。E-SGRN-Astral注释的2279、3537、2215、1267、3932和4863代谢物特征,分别来自NIST SRM 1950人血浆、NIST SRM 3667人尿液、组织、细胞、粪便和合并样本(图3b)。相反,通过将MS1、MS/MS和tR与NIST SRM 1950 人血浆、NIST SRM 3667 人尿、组织、细胞、粪便和混合样品的标准品进行匹配,仅鉴定出100、101、122、72、99和110种代谢物。这些结果表明E-SGMN-Astral相对于传统方法的优越注释能力。因此,E-SGMN对于高性能Orbitrap Astral数据集中的大规模代谢物注释更为有效。
在RPLC-ESI+-HRMS/MS中,比较了E-SGMN-Astral和SGMN-QE HF对六种生物样品的注释性能(图3c)。结果表明,E-SGMN-Astral注释的代谢物特征数量是SGMN-QE HF的2.9-4.3倍。
为了评估Orbitrap Astral的贡献,比较了SGMN-QE HF和SGMN-Astral的注释结果。结果发现,QE HF和Astral分别检测到6047和17,504个代谢物特征。其中,4231(69.97%)和 14,830(84.72%)个特征具有相应的MS/MS谱(图3d)。此外,SGMN-QE HF和SGMN-Astral分别注释了705和1870个代谢物。这代表仅由Orbitrap Astral实现的注释覆盖率增加了165%,主要归因于其更快的 MS/MS 扫描速度和更高的检测灵敏度。
通过比较SGMN-Astral和E-SGMN-Astral来评估E-SGMN的影响。加入3948个额外的高置信度候选物后,E-SGMN网络大小比原始SGMN增加了22.4%。SGMN-Astral和E-SGMN-Astral分别注释了1870和2279个代谢物(图3d)。这表明,与基础SGMN相比,仅E-SGMN就将注释覆盖率提高了21.9%。注释代谢物的增加比例相对于映射特征的增加比例更大,这证明了E-SGMN在扩展代谢物覆盖范围方面的有效性。
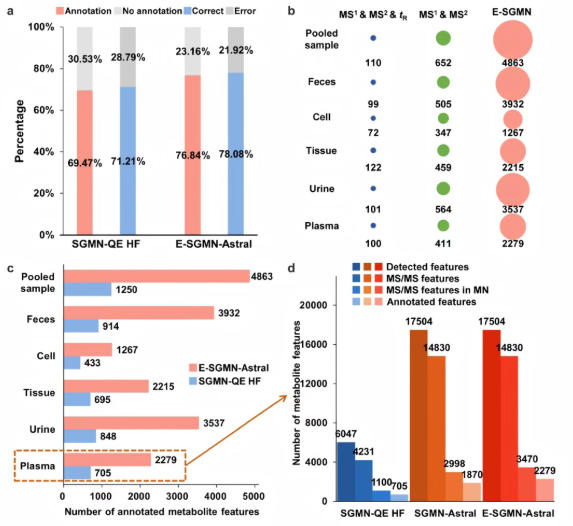
图3. RPLC-ESI+-HRMS/MS中注释性能的验证
最后,为了评估Orbitrap Astral和E-SGMN的综合影响,比较了QE HF-SGMN和Orbitrap Astral-E-SGMN的注释性能。如图3d所示,Orbitrap Astral和E-SGMN的组合导致网络映射特征增加了215%,注释覆盖率增加了223%。这种非累加增益突出了先进质谱仪器和数据驱动注释策略的互补优势。具体而言,Orbitrap Astral由于其改进的检测能力而提供了更丰富的光谱数据,E-SGMN利用这些数据来最大化注释性能。
进一步比较了E-SGMN-Astral和SGMN-QE HF之间的重叠和唯一注释。E-SGMN-Astral和SGMN-QE HF分别注释了5440和1507个代谢物特征。两种方法都检测和注释了1226个代谢物特征的共同集合(图4a)。E-SGMN-Astral唯一注释了4214个代谢物特征,包括低丰度代谢物,其平均峰值强度较低(图4b)。这些发现表明,E-SGMN-Astral有效地捕获了传统工作流程中经常忽略的低丰度代谢物特征。通过将Orbitrap Astral的卓越检测能力与E-SGMN增强的注释策略相结合,实现了全面和高度特异性的代谢物鉴定。
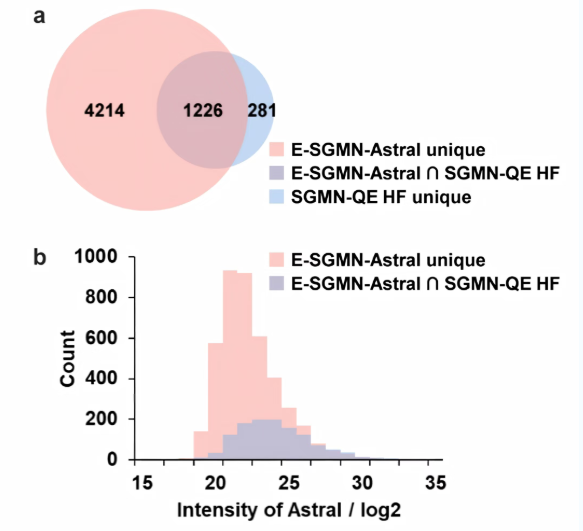
图4. E-SGMN-Astral和SGMN-QE HF之间的重叠和唯一注释比较
研究小结
在这项研究中,E-SGMN策略是专门为Astral质谱仪开发的。与现有的分子网络注释方法不同,E-SGMN整合了先前测量的代谢物和由Astral MS数据过滤的潜在代谢物。这种构建策略允许在背景网络中包含更有效的候选物,同时最大限度地减少不相关分子的引入,从而在网络内实现标注覆盖率和准确性之间的最佳平衡。对六种不同生物基质的比较分析表明,Astral与E-SGMN集成的性能优于QE HF仪器,注释代谢物特征的数量显著增加。从NIST SRM 1950人血浆中,注释了5440个特征,是QE HF的3.6倍。与其他注释方法相比,E-SGMN的注释数量增加了3.7-44.2倍,突出了这种组合方法在更广泛的代谢物覆盖方面的潜力。E-SGMN更高的注释覆盖率和更精确地检测和注释代谢物的能力为研究人员提供了一个变革性的工具,允许更全面地了解复杂的生物系统。Astral与E-SGMN的整合代表了在追求更准确和高效的代谢组学分析方面向前迈出的重要一步,对生物医学研究和生命科学具有深远的意义。
综上所述,Orbitrap Astral质谱仪凭借其超高灵敏度、快速MS/MS采集能力与高质量数据输出,为代谢组学研究提供了坚实的技术基础。无论是通过Denoising Search提升谱图质量,还是借助E-SGMN扩展注释网络,Astral平台均展现出在提升化合物鉴定数量、覆盖广度与注释可信度方面的显著优势。两项研究共同证明,Astral不仅推动了仪器性能的边界,更通过与先进算法的深度融合,开启了代谢组学研究的新纪元。未来,随着更多定制化分析流程的开发与多组学整合策略的推进,Astral有望在疾病机制解析、生物标志物发现及精准医学应用中发挥更加关键的作用。