
英文标题:Diosgenin in Dioscorea spongiosa Suppresses Glycolysis-Driven Angiogenesis as a ROCK1 Inhibitor
中文标题:萆薢中的diosgenin通过抑制ROCK1抑制糖酵解驱动的血管生成
发表期刊:Journal of Agricultural and Food Chemistry
影响因子:6.2
客户单位:皖南医学院
百趣提供服务:DIA中药入血组、新一代代谢组学NGM 2 Pro、AQ能量代谢
研究背景
类风湿关节炎(RA)是一种以慢性滑膜炎和血管异常增生为特征的自身免疫性疾病。血管内皮细胞(HUVECs)的代谢重编程和异常活化会导致血管生成,进而加剧滑膜炎症与组织破坏。已有研究表明,活化的HUVECs即使在富氧环境中仍主要依赖糖酵解供能。因此,干预HUVECs的活化及其代谢状态成为RA的潜在治疗策略。课题组前期研究发现,清络饮(QLY)具有良好的抗血管生成作用,而其中关键中药成分萆薢(BX)可能通过调控代谢通路发挥作用。但目前BX是否以及如何干预RA中HUVECs的活化过程还尚不明晰。因此,本研究基于BX提取物,结合体内外模型验证、代谢组分析、成分筛选与靶点识别等方法,探讨BX对HUVECs活化及血管生成的调控机制,为RA治疗提供新的天然药物来源。
研究结果
1、BX治疗显著调节了佐剂性关节炎(AIA)大鼠的代谢状态
BX治疗AIA大鼠28天后,显著降低关节炎评分并减缓体重下降(图1A-B),同时抑制炎症因子(IL-1β、IL-17A、iNOS)表达,改善氧化应激指标MDA、SOD、GSH(图1C-D)。BX还缓解了关节畸形和滑膜增生(图1E-F),降低AKP水平(图1G)。BX恢复了AIA引起的WAT体积降低(图1H-I)、抑制血糖升高(图1J),并降低关节内T-CHO和丙酮酸水平(图1K),表明其具有调控糖酵解能力。
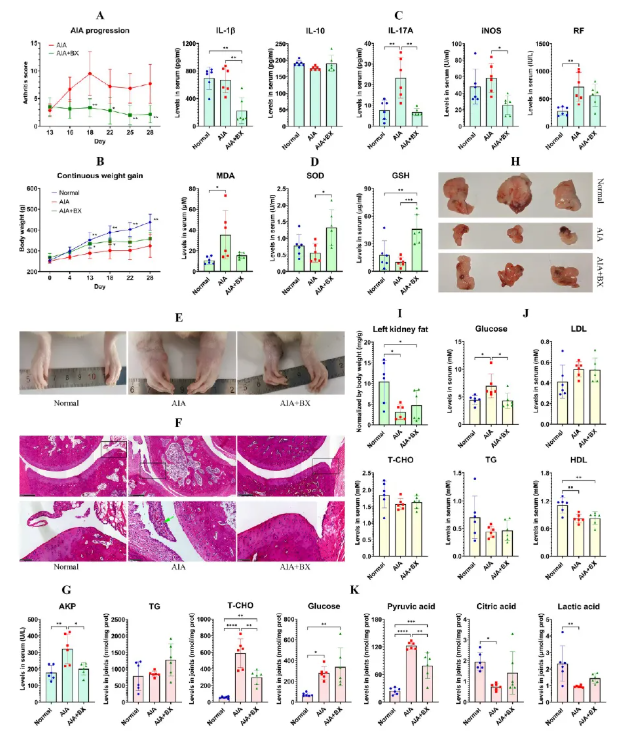
图1 BX治疗改善AIA大鼠的代谢和免疫异常
代谢组学分析显示,正常、AIA组与BX组代谢谱存在差异,其中代谢调控网络揭示VEGF和脂肪因子信号通路在RA代谢中起重要作用(图2A-C)。共鉴定到一批脂类相关的差异代谢物,其中第7类主要为脂肪酸,它在BX处理后明显恢复(图2D-F)。KEGG富集分析表明,BX可逆转AIA模型中脂肪酸生物合成受抑的状态(图2G),表明其能够调控脂质代谢,通过作用于WAT间接影响血管生成。
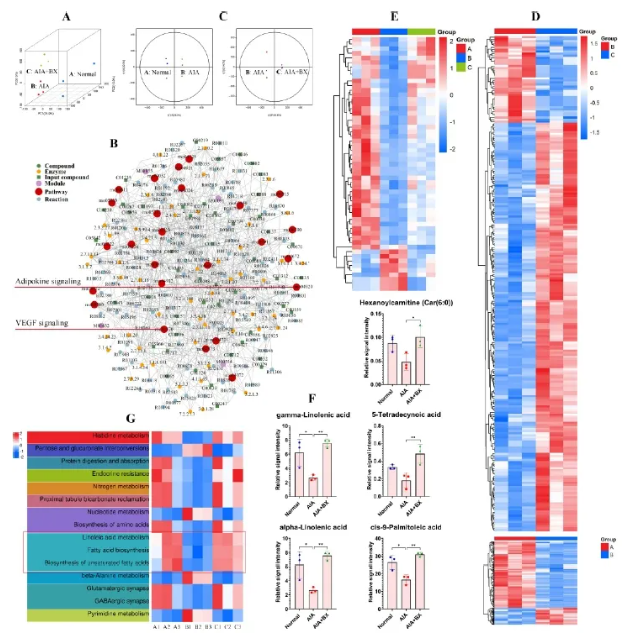
图2 QLY治疗恢复AIA大鼠关节的代谢谱异常
2、BX通过代谢重编程抑制AIA诱导的血管生成
BX治疗恢复AIA大鼠脂肪细胞形态并减少WAT内血管生成(图3A)。BX恢复了AIA诱导的T-CHO、DAG、油酸和血糖异常(图3B),并下调脂肪酸氧化相关基因(图3C)。BX显著抑制脂肪因子visfatin,同时下调WAT中visfatin、HIF-1α和VEGF的表达(图3D-E)。免疫组化结果显示,BX可降低AIA模型中visfatin与CD31阳性血管的表达(图3F),表明BX通过调节脂肪组织代谢与脂肪因子分泌,抑制血管生成。
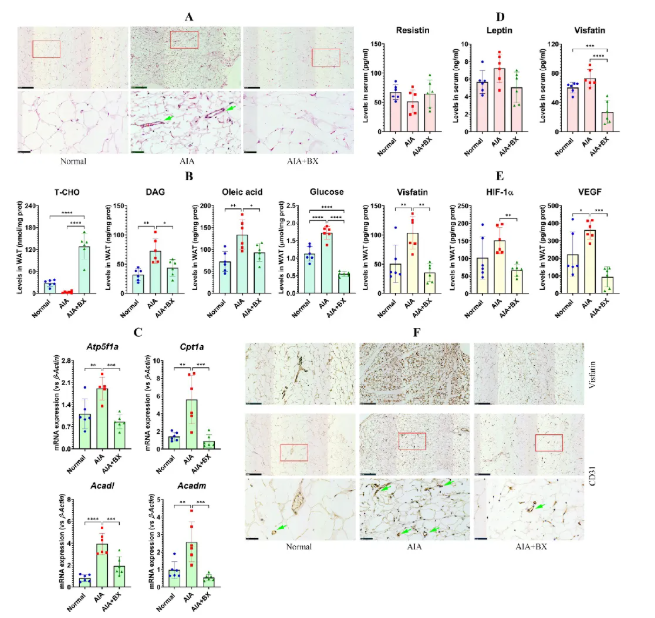
图3 BX通过代谢重编程抑制了AIA诱导的血管生成
在AIA模型中,滑膜及Matrigel组织中新生血管显著增多,BX治疗后血管减少(图4A-C)。BX抑制了VEGF和PDGF分泌,并显著下调关节中PKM表达(图4B-D)。在HUVECs中,BX可抑制糖酵解代谢,提高TCA中间产物(图4E-H)。综上所述,BX通过改善免疫微环境和抑制糖酵解,干预血管生成过程(图4I)。

图4 糖酵解抑制参与了BX对AIA大鼠的抗血管生成作用
3、糖酵解抑制介导了BX在体外的抗血管生成作用
BX对HUVECs活性的抑制依赖于浓度,50-800 μg/mL范围内有效(图5A)。BX处理后可降低葡萄糖代谢产物及MDH活性(图5B-C),同时抑制HUVECs迁移、成管与划痕修复能力(图5D)。BX在50 μg/mL时仍能抑制对被VEGF活化HUVECs的葡萄糖代谢产物、MDH活性和血管生成(图E-G)。此外,BX还下调糖酵解相关基因及信号蛋白表达(图5H-I),表明其通过糖酵解通路抑制HUVECs活化。
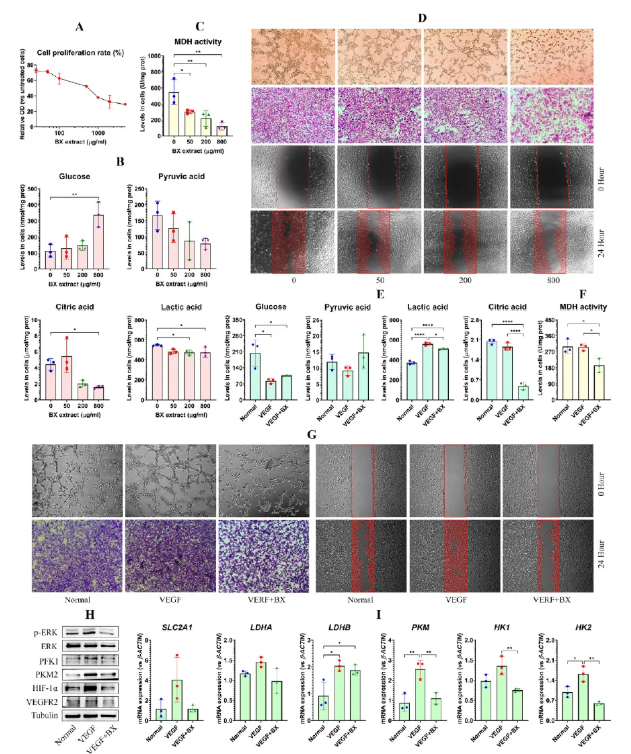
图5 BX通过抑制糖酵解途径抑制了HUVECs的活化
4、diosgenin是BX提取物中的关键的抗血管生成成分
BX提取物按极性分为30个组分,筛选发现第14组分抗糖酵解作用最显著(图6A-C)。利用DIA中药入血组分析,发现第14与29组分中共存在19种代谢物,其中diosgenin在两个组分中均丰度较高,且在BX原药中含量较高(图6D-F)。而dioscin虽丰度高,但血清中浓度低,这是由于其在体内可被水解为diosgenin(图6G)。综合结果表明,diosgenin是BX发挥药效的关键活性成分。
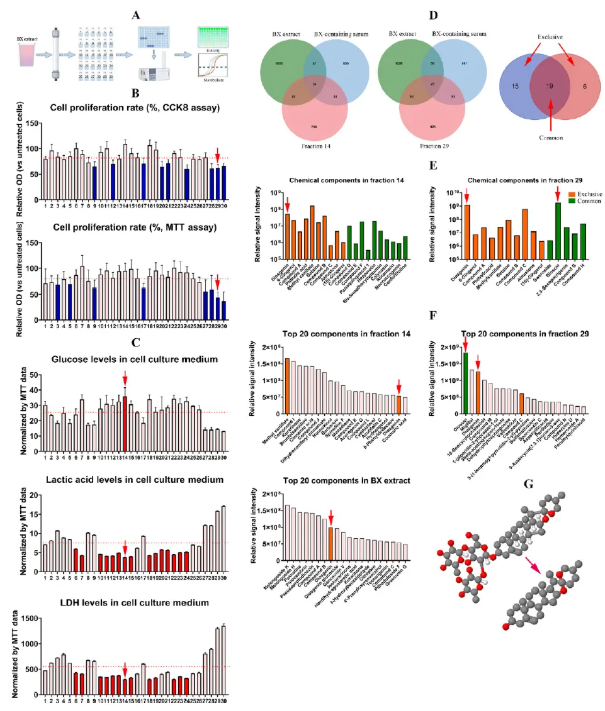
图6 diosgenin是BX提取物中对HUVECs具有抑制作用的关键成分
与methyl vanillate(两个组分共存的成分)、hesperetin(BX的提取物)比较,diosgenin显著抑制HUVECs增殖且不损伤细胞,并提高培养基中丙酮酸残留(图7A-B)。其有效下调糖酵解关键基因和PFK和PKM的酶活性,减少乳酸和丙酮酸生成(图7C-D)。diosgenin抑制VEGF诱导的成管及VECs活化相关蛋白和糖酵解基因的表达(图E-G)。表明BX能够通过多通路抑制HUVECs活化。
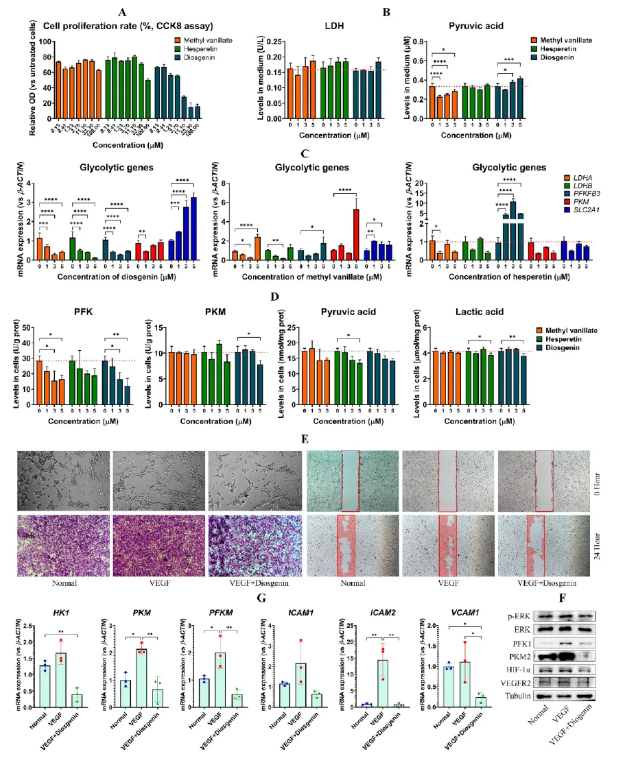
图7 diosgenin同时抑制HUVECs的活化与糖酵解过程
5、diosgenin通过靶向结合ROCK1抑制HUVECs的活化
通过生物素标记diosgenin进行pull-down实验,确认ROCK1为其特异结合蛋白(图8A-C)。分子对接及动力学模拟表明diosgenin可稳定嵌入ROCK1催化结构域且不影响构象(图8D-E)。diosgenin可与biotin-diosgenin竞争结合ROCK1(图8F),并保护其免受热与酶降解(图8G-H),同时显著抑制ROCK1磷酸化(图8I),其结合关系经WB&IF试验进一步验证(图8J)。
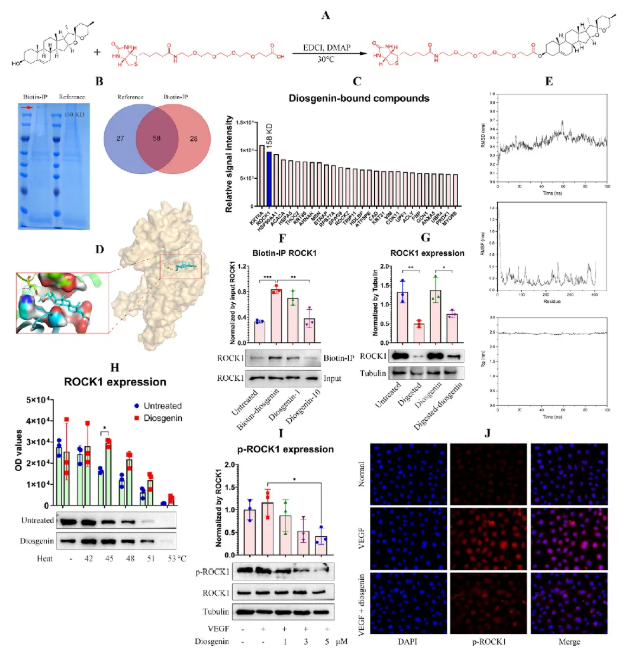
图8 diosgenin靶向结合HUVECs中的ROCK1
diosgenin与ROCK1抑制剂GSK429286A作用一致,均可抑制VEGF诱导的血管生成及相关基因表达(图9A-B)。在敲除ROCK1下,VEGF不再诱导血管生成,且diosgenin失去抑制作用(图9C-E),乳酸与MDH水平亦未改变(图9F)。此外,ROCK1激动剂arachidonate可部分拮抗diosgenin抑制效应(图9G-H)。综上,diosgenin依赖ROCK1实现其抗血管生成功能。
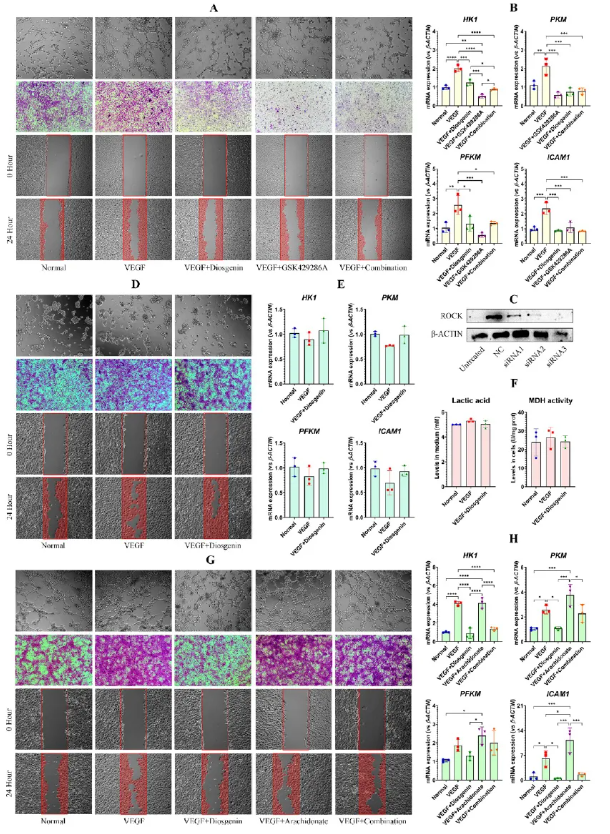
图9 diosgenin依赖ROCK1信号通路抑制细胞血管生成
研究结论
本研究揭示了中药萆薢(BX)在调控脂质代谢、糖酵解及抑制血管生成方面的作用机制。通过代谢组学筛选与机制验证,确定了diosgenin是BX中治疗RA的关键活性成分。diosgenin通过靶向结合ROCK1蛋白,抑制其磷酸化,从而阻断ROCK1介导的HUVECs过程,包括迁移、成管与糖酵解功能。
对DIA中药入血组感兴趣的老师同学,欢迎联系百趣生物当地的销售工程师了解详情。也欢迎后台留言详询百趣产品与服务。
