单细胞多组学技术通过整合基因组学、转录组学、蛋白质组学和代谢组学等多种组学数据,为深入理解细胞异质性、细胞功能调控以及疾病发生发展机制提供了前所未有的机会。这些技术的发展极大地推动了生物医学研究,尤其是在肿瘤研究、免疫学研究以及药物研发等领域。然而,仅依靠单细胞层面的研究,对于脂质等代谢物的精细解析仍存在局限。
脂质作为构成细胞膜及细胞器膜的特征性生物分子,通过在细胞内形成膜结构区室化分隔,界定了多种细胞器的形态与功能边界。与此同时,脂质广泛参与细胞信号转导、能量储存等核心生理过程,精准调控细胞增殖、分化、应激响应等关键生命活动。不同细胞器的脂质组成具有高度特异性,其种类、比例及空间分布对细胞器的生理功能行使(如物质运输、信号传递)及病理状态转换(如膜结构损伤、功能失调)具有决定性影响。因此,建立活细胞内多种脂质的精准定性、定量分析方法,并实现其动态变化的实时监测,对于深入解析代谢性疾病、神经退行性疾病及脂质贮积症等重大人类疾病的病理机制,揭示脂质代谢异常与疾病发生发展的关联,具有不可或缺的理论价值与应用前景。
昨日,中国科学院上海有机化学研究所生物与化学交叉研究中心朱正江研究员团队与生命过程小分子调控全国重点实验室陈以昀研究员团队合作在化学领域顶级学术期刊nature chemistry(IF=20.2)发表题为“Quantitative profiling of lipid transport between organelles enabled by subcellular photocatalytic labelling”的研究论文。本研究创新性开发了亚细胞定位邻近标记脂质组学技术,结合稳定同位素示踪与高分辨质谱组学分析,无需分离细胞器即可精准测定活细胞内不同细胞器的脂质组成及细胞器间脂质转运等时空动态变化规律。
朱正江研究员课题组长期与百趣生物开展代谢组学技术合作,多项代谢组学技术(如MetDNA、MetTracer等)已经授权百趣生物商业化使用,并担任首席科学家。此次,将继续同百趣生物开展邻近标记脂质组学技术的相关合作,推出基于邻近标记技术的亚细胞脂质组学科研服务产品,感兴趣的老师请留言或和我们当地的销售工程师咨询。

英文标题:Quantitative profiling of lipid transport between organelles enabled by subcellular photocatalytic labelling
中文标题:亚细胞定位邻近标记脂质组学技术及细胞器间脂质转运研究
发表期刊:nature chemistry
影响因子:20.2
研究背景
脂质作为生命活动的核心物质,在细胞功能中扮演着多重关键角色。细胞内不同亚细胞结构凭借独特的脂质组成,精准支持特定的生化反应与功能需求。而脂质在细胞器间的有序转运,更是维持细胞结构稳定、能量代谢平衡及信号调控的核心环节。
近年来,细胞器间脂质转运研究主要依赖荧光标记技术、点击化学标记以及质量标签标记等方法。例如,点击化学标记技术通过将叠氮基团引入脂质分子来完成标记;质量标签标记技术则利用两种酶分别在供体与受体细胞器的脂质上添加不同化学标签,以此量化内质网与线粒体间的脂质交换。然而,上述这些方法大多会改变脂质的分子结构,进而影响其在活细胞中的亚细胞分布、细胞器间运输及细胞代谢过程。
邻近标记技术是一种在蛋白质等生物大分子亚细胞区室化分布及相互作用网络研究中广泛使用的技术,具有高时空分辨率、高标记效率的优势。其基本原理是将目标蛋白(a)与催化酶(b)共表达,在细胞内催化产生活性小分子(c),这些活性小分子(c)会标记目标蛋白周围的蛋白(d),随后将被活性小分子(c)标记的蛋白(d)富集出来,便可高效研究目标蛋白(a)能与哪些蛋白(d)进行互作。近年来,邻近标记技术更是扩展至光催化领域,上海有机所陈以昀研究员团队早期已实现使用有机染料等小分子光催化剂,在亚细胞区间内产生活性分子并标记蛋白质。然而,目前邻近标记技术仍局限于蛋白质研究领域。由于脂质分子结构具有高度多样性且缺乏有效富集策略,如何将该技术拓展至活细胞脂质亚细胞区室化表征仍面临挑战。
本研究创新性地将光催化邻近标记技术拓展至脂质组学领域,通过采用细胞器选择性有机染料吸收光能,催化标记探针产生活性分子。经过合理设计的标记探针能增强与脂质的疏水相互作用,从而实现高效、选择性的脂质邻近标记。该技术有助于开展亚细胞脂质组成的空间分辨研究,并被用于定量分析内质网与线粒体、细胞核或溶酶体之间的脂质转运与代谢过程。
研究结果
1、脂质特异性光催化探针的设计
结合脂质的特点,研究团队设计了一种适用于脂质标记的小分子探针【phenyl azide–alkyl–tertiary amine】(简称为AzPh–alkyl–TA)。AzPh是反应基团,负责和脂质结合;alkyl可以称作疏水连接链,用于连接反应基团与电离增强基团,并且能够增加小分子探针的亲脂性,使其能够更好地与亚细胞器脂质双层膜的相互作用;TA是电离增强基团,用于增强小分子探针的质谱响应灵敏度,便于探针在质谱中产生更好的响应。当处于蓝光(波长λ=468 nm)的照射下时,有机染料便会催化反应基团(AzPh)与脂质的亲核头部结合,使脂质连接上探针信号(图1a)。
为了探究AzPh–alkyl–TA探针与脂质间的光催化反应,研究团队设计了一个体外反应体系,包括由脂质标准品配制的脂质体(用于体外模拟细胞器的磷脂双分子结构)、AzPh–alkyl–TA探针以及有机染料(分别设计了三种染料的平行实验),并使用蓝光照射。通过检测不同光催化标记脂质的量,来分析不同脂质的光催化效率。结果显示,在Rh123、AO或fluorescein等有机染料的催化下,PE、PS、Sph、LPE、LPS这五类具有亲核基团的脂质具有更强的光催化反应活性(图1b)。
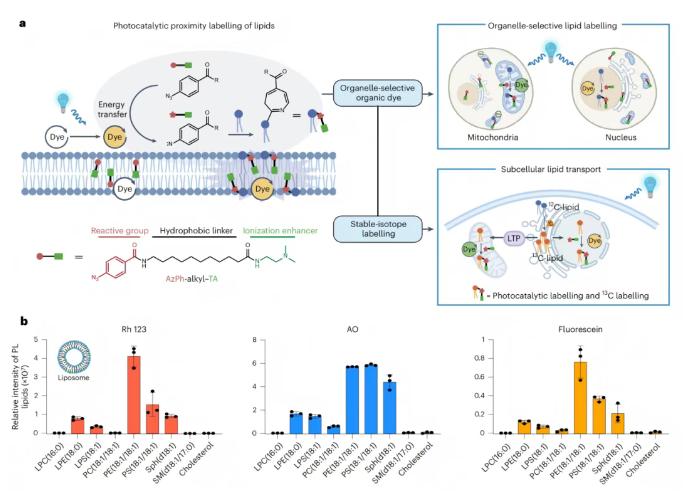
图1. 以有机染料为光催化剂的脂质光催化标记
2、细胞器选择性光催化脂质的标记
为了实现不同细胞器脂质的针对性检测,研究团队选用了不同的细胞器选择性染料。首先是Rh123,这种染料可以选择性的染线粒体,在HeLa细胞中,通过依次孵育Rh123染料、AzPh–alkyl–TA探针并进行蓝光照射,实现了线粒体特异性脂质的光催化标记,随后使用高分辨质谱组学技术检测,在线粒体中鉴定到涵盖七大类的共计64种脂质(图2a)。为了进一步确认光催化标记脂质的线粒体定位,研究团队设计了另一种结构类似的光催化探针,用于光催化标记脂质的亚细胞定位分析,发现光催化标记脂质的位置和线粒体定位蛋白TOMM20位置高度重叠(图2b),表明Rh123催化下的光催化标记脂质确实能够有效定位于线粒体。此外,实验表明探针在细胞内的分布无细胞器偏好性,选择性主要通过有机染料实现;且未施加蓝光照射或缺少有机染料的对照组中均未检测到标记信号。随后研究团队分别用AO和DND-189两种细胞器选择性染料,在细胞核和溶酶体中检测到了74种和79种脂质。并通过亚细胞定位实验证实了,两种细胞器选择性染料催化的光催化标记脂质分别位于细胞核和溶酶体(图2c-f)。线粒体特异性邻近标记技术与传统线粒体分离对照实验,以及线粒体酶活抑制和基因敲除实验,均表明基于光催化剂的脂质邻近标记技术在活细胞中实现了卓越的细胞器特异性(图2g-h)。
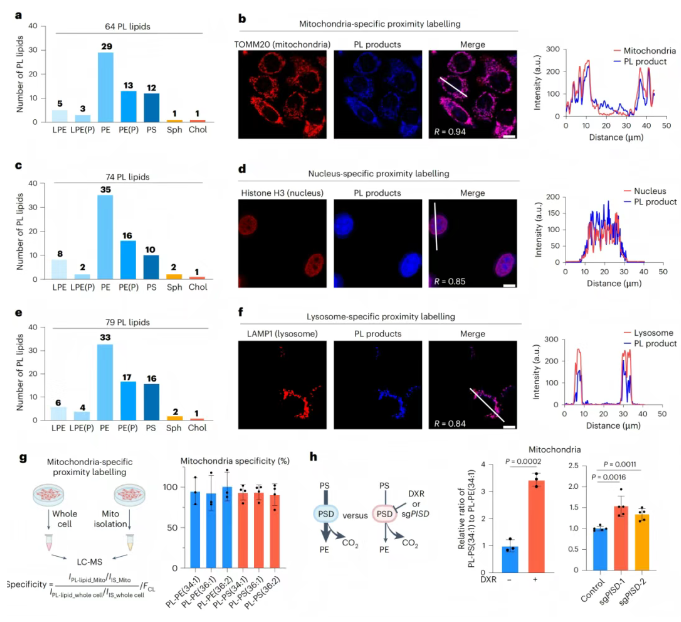
图2. 活细胞中脂质的细胞器选择性光催化标记
3、从内质网到线粒体的脂质转运分析
在真核细胞中,多数磷脂在内质网合成,随后转运至其他细胞器。例如,PS由丝氨酸与内质网中的PE或磷脂酰胆碱经头部交换反应合成,之后转运至线粒体;且当PS转运至线粒体后又会被磷脂酰丝氨酸脱羧酶(PSD)迅速转变为PE(图3a)。为表征这一脂质转运及转化过程,研究团队设计了一种“邻近标记+13C同位素标记”双标记实验:在内质网整合稳定同位素标记技术,在线粒体采用光催化邻近标记法。具体来说,用13C标记的丝氨酸(丝氨酸是PS合成的底物)处理HeLa细胞,使得内质网中新合成的PS脂质被13C标记,当这些脂质被转运至线粒体后,其产物13C-PE可被Rh123催化的AzPh–alkyl–TA探针选择性标记,随后提取检测双标记脂质(13C光催化标记PS和13C光催化标记PE)。为了验证数据的可靠性,研究团队通过PE合成抑制剂实验和PE合成基因敲除实验,均证明了内质网中新合成PS脂质可被转运至线粒体并转化为PE脂质(图3b-c)。
为了进一步分析内质网到线粒体的脂质转运动力学过程,研究团队使用脉冲-追踪实验(Pulse-chase labeling),分析脉冲标记后15、30、45、60、90、120min时线粒体中源自内质网PS转运来的PE含量,研究发现,内质网到线粒体的转运是个快速的过程,大约在1h内完成(图3d);并通过长达72h的连续稳定同位素标记实验,发现不同脂肪酰基的PE呈现不同的转运速率(图3f);一阶速率方程定量分析表明,高周转率PE和低周转率PE间周转率相差巨大,高周转率组的周转率k为0.05/小时,而低周转率组仅为0.03/小时(图3e)。最后,研究团队分析了线粒体中PSD催化新合成的PE含量,发现该途径来源的PE占线粒体中总PE的59.9%(图3h)。
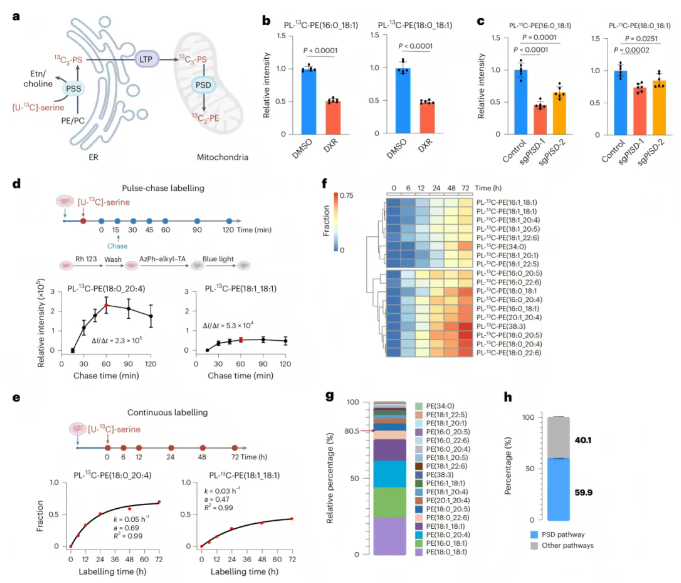
图3. 从内质网到线粒体的脂质转运的定量分析
已知除PSD途径外,线粒体中PE的另一条关键来源途径是CDP-乙醇胺途径(CDP-Etn)。这些PE源自内质网内通过CDP-乙醇胺途径的PE从头合成,并直接转运至线粒体(图4a)。为探究该途径对线粒体中PE的贡献,研究团队采用与上述类似的研究方法。首先,用13C标记的乙醇胺(乙醇胺是PE脂质合成的底物)孵育HeLa细胞,并在线粒体中检测13C和光催化双标记的PE,共检测到18种(图4b)。CDP-Etn抑制剂实验显示,线粒体中双标记PE的含量显著降低(图4d)。脂质动力学分析和多标记实验表明,PSD途径和CDP-Etn途径对线粒体PE的贡献存在互补作用,且PSD途径占主要地位,贡献了59.9%的PE,而CDP-Etn途径贡献了约19.2%(图4i)。
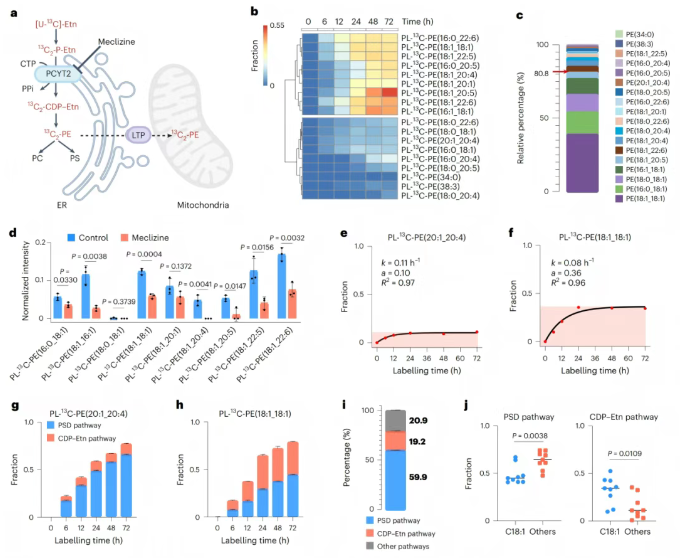
图4. 从内质网到线粒体的PE脂质周转定量分析
4、细胞核脂质周转的定量分析
围绕细胞核的脂质代谢分析研究发现,使用细胞核选择性光催化剂染料AO催化后,在细胞核测到了21种双标记PE(图5b),13C标记的乙醇胺孵育后发现,细胞核中来源于内质网CDP-Etn途径的PE主要为PE(18:1_18:1)、PE(16:0_18:1)和PE(18:0_18:1),这三种PE占总内质网来源PE的69.3%(图5c),有趣的是PE(18:1_18:1)虽具有较高的代谢率但转化速度较慢,表明其在核内存在复杂的代谢动态(图5d)。最终的定量分析显示,内质网合成的21种PE脂质贡献了核内总PE脂质的52.2%(图5e)。针对PS的检测发现,内质网中合成的十种PS脂质贡献了细胞核内总PS脂质的74.9%(图5j)。此外13C标记丝氨酸实验发现,细胞核中有34.1%的磷脂来源于PSD途径(即线粒体中PS脂质经过PSD催化合成PE脂质),而PSD酶主要定位于线粒体,表明线粒体中通过PSD途径合成的磷脂同样对细胞核内的磷脂组成具有重要贡献。
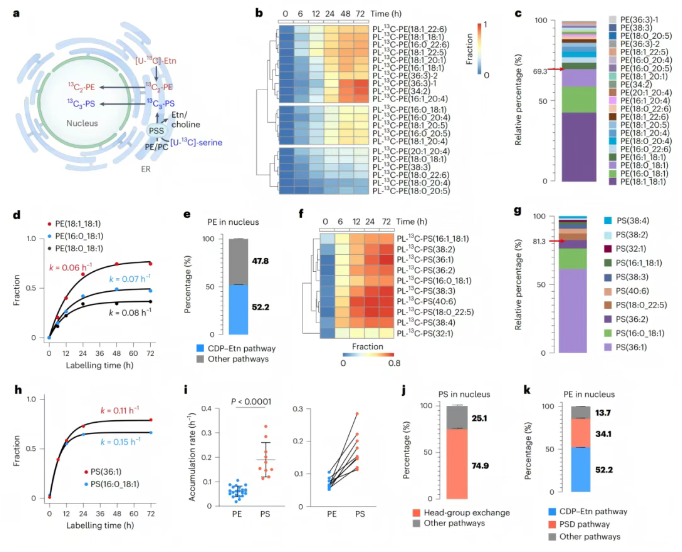
图5. 细胞核脂质周转的定量分析
5、光催化标记法溶酶体脂质分析
溶酶体作为关键的降解细胞器,在细胞代谢和信号传导中发挥着重要作用。通过双标记策略,研究团队定量分析了溶酶体内18种双标记PE的来源(图6a),定量分析表明,CDP-Etn途径贡献了60.8%的溶酶体PE脂质,而PSD途径占31.3%(图6b)。mTOR是一种丝氨酸/苏氨酸蛋白激酶,通过感知营养物质和生长因子等环境信号来调控代谢网络和细胞稳态,研究团队发现,激活mTOR后,在对整体细胞脂质无明显影响的基础上,显著改变了溶酶体脂质组成(图6e),具体表现为促进溶酶体中胆固醇、PE、PS及PE(P)脂质含量的显著增加(图6f),这些发现建立了mTOR激活与溶酶体脂质蓄积之间的直接功能联系。
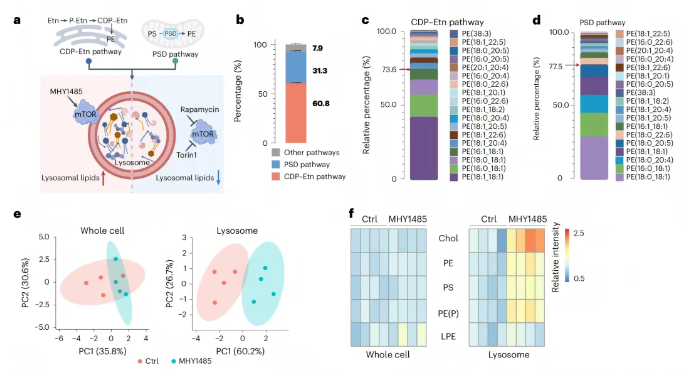
图6. 溶酶体中PE脂质来源和代谢的定量表征
研究结论
本研究创新性地开发了亚细胞定位邻近标记脂质组学技术,结合高分辨质谱驱动的脂质组学分析方法,成功实现了对线粒体、细胞核及溶酶体等常见细胞器脂质组成的系统性解析;通过整合稳定同位素示踪标记技术,进一步建立了细胞器间脂质运输的定量表征体系。研究首次从定量层面阐明了各类脂质合成途径与运输途径对特定细胞器脂质组成的贡献机制,为探索亚细胞水平脂质代谢的调控规律及相关疾病的分子机制提供了重要技术支撑。百趣生物在代谢组学技术领域积极探索,持续深耕精细化代谢组学研究,对亚细胞脂质组学感兴趣的科研同路人欢迎联系百趣各地销售工程师进行深度技术交流。