
英文标题:Integrating single-cell and spatial transcriptomics reveals the cellular heterogeneity of vestibular schwannoma
中文标题:整合单细胞与空间转录组学揭示前庭神经鞘瘤的细胞异质性
发表期刊:npj precision oncology
影响因子:8
研究背景
前庭神经鞘瘤(Vestibular Schwannoma, VS)是一种起源于前庭耳蜗神经鞘施万细胞的良性肿瘤,可导致显著的神经和听觉并发症,但其发展机制和空间异质性仍知之甚少。作为常见的颅内占位性病变,VS占所有颅内肿瘤的7%–12%,占桥小脑角肿瘤的80%–95%,现有治疗策略存在局限性,深入探究其发病的分子驱动机制对改善临床结局至关重要。单细胞RNA测序技术虽已揭示VS中施万细胞的异质性及基质细胞的作用,但缺乏空间定位信息,而空间转录组学可提供基因表达的空间分布,为此本研究整合两种技术以解析VS的细胞异质性。
技术路线
研究结果
1、单细胞图谱揭示了人类前庭神经鞘瘤组中的主要细胞类型
研究人员整合了三个前庭神经鞘瘤(VS)肿瘤组织的单细胞RNA测序(scRNA-seq)数据(图1a),通过无监督聚类分析鉴定出八个主要细胞群,并依据已发表研究的典型谱系特异性标志物进行注释,分别为:施万细胞(SOX2、PMP2、S100B)、巨噬细胞(PTPRC、CD68、CD74)、T细胞(CCL5、TRBC2、CD3E)、中性粒细胞(S100A9、S100A8)、肥大细胞(TPSB2、CPA3、MS4A2)、成纤维细胞(DCN、LUM、CYP1B1)、血管平滑肌细胞(RGS5、ACTA2、TAGLN)和内皮细胞(PLVAP、VWF、FLT1)。研究还系统整理了跨细胞谱系的亚群特异性标志物参考面板(图1d),为深入探究VS的异质性奠定了基础。
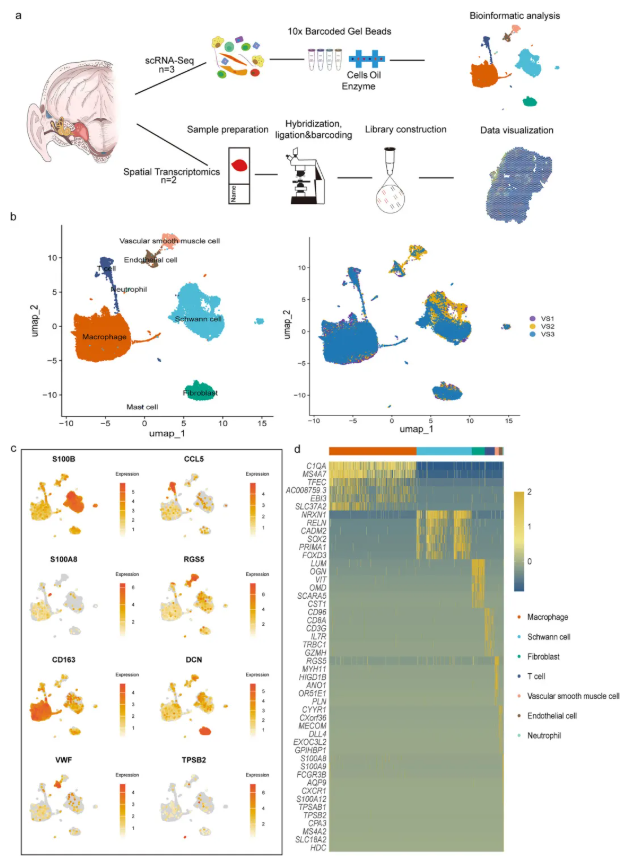
图1. 前庭神经鞘瘤的单细胞转录组分析
2、前庭神经鞘瘤中的差异基因表达及施万细胞亚群动态
施万细胞是VS中主要的肿瘤细胞群,且在肿瘤发生过程中经历动态转录重塑,研究人员对VS肿瘤中的施万细胞亚群进行了分析。通过聚类,在单细胞RNA测序数据中识别出5种亚群:NOVhi SC、JUNB+SC、PMP2+SC、VEGFA+SC和PRX+SC。结合基因本体(GO)富集分析发现:JUNB+SC在发育调节通路(如神经胶质生成、髓系分化、神经系统发育)中显著富集(图2a-b);NOVhi SC与轴突形态发生和突触组织相关(图2c-d);PRX+SC主要参与能量代谢(如核糖磷酸代谢过程、有氧呼吸)和细胞骨架组织(如肌动蛋白丝组织)(图2e-f);PMP2+SC富集于翻译机制相关通路(如细胞质翻译、核糖核蛋白复合体生物发生)(图2g-h);此外,VEGFA+SC作为关键的基质相互作用细胞,表现出血管生成(如细胞外基质组织、伤口愈合)、增殖(如上皮细胞增殖)及蛋白酶调节相关特征(图2i-j)。
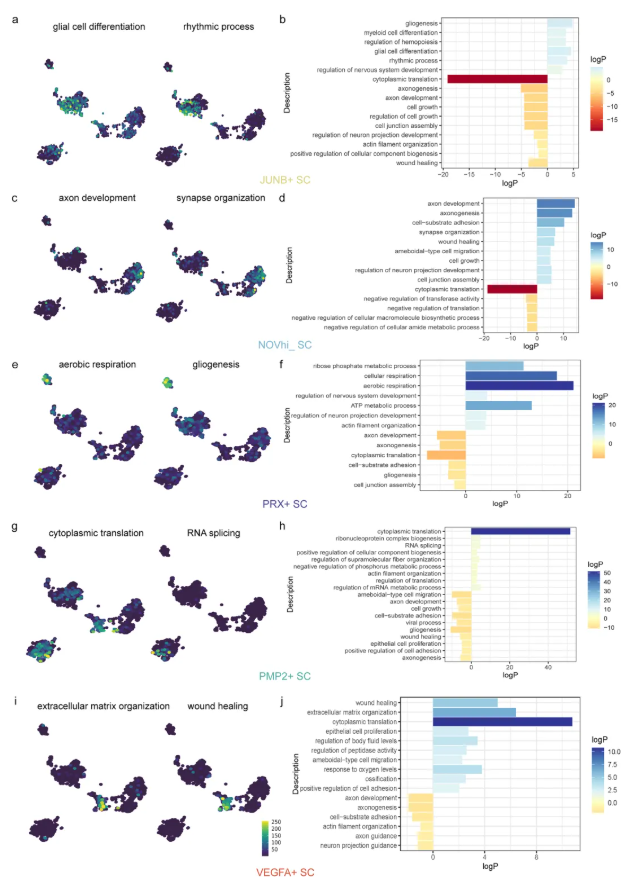
图2. 基于单细胞RNA测序的前庭神经鞘瘤中五种施万细胞亚群的GO分析
3、空间转录组学结合单细胞RNA测序揭示了前庭神经鞘瘤样本的区域化特征
对两个VS标本的空间转录组学分析显示:VS_S1标本共鉴定出2294个高质量空间位点,中位测序深度为每个位点224,536条读段(图1a)。HE染色结果显示,VS_S1标本主要表现为Antoni-A型组织病理模式(图3a),空间反卷积分析验证了这一特征,表现为巨噬细胞、成纤维细胞、血管平滑肌细胞(VSMCs)、内皮细胞、T细胞、中性粒细胞和肥大细胞的丰度评分相对较低。
为分析细胞群落的空间依赖性,研究人员评估了三个空间尺度(位点内约55μm、近端视野约200μm、远端视野约3000μm)下,细胞邻域背景(以相邻区域细胞类型组成为特征)对位点水平主要细胞类型丰度的预测能力。结果显示:内皮细胞对血管平滑肌细胞(VSMCs)丰度的预测能力较强,反映了血管相关细胞类型间的功能关联性;施万细胞对成纤维细胞、巨噬细胞、肥大细胞、中性粒细胞和T细胞的丰度预测能力最高;且成纤维细胞与施万细胞存在显著共定位关系(表明两者存在明显细胞依赖性),巨噬细胞与成纤维细胞也呈显著相关性(与成纤维细胞介导的巨噬细胞趋化机制一致)。这些结果凸显了血管相关细胞类型与施万细胞在前庭神经鞘瘤发病机制中的生物学意义(图3e)。
VS_S2标本共鉴定出2799个高质量位点,中位测序深度为每个位点179,011条读数。HE染色显示,该样本同时存在Antoni-A型和Antoni-B型结构模式(图4a),空间反卷积分析验证了这一病理特征(图4d)。与VS_S1一致,VS_S2维持了显著的淋巴-髓系相互作用网络,保留了保守的免疫细胞相互作用及炎症微环境特征(图4d-e)。
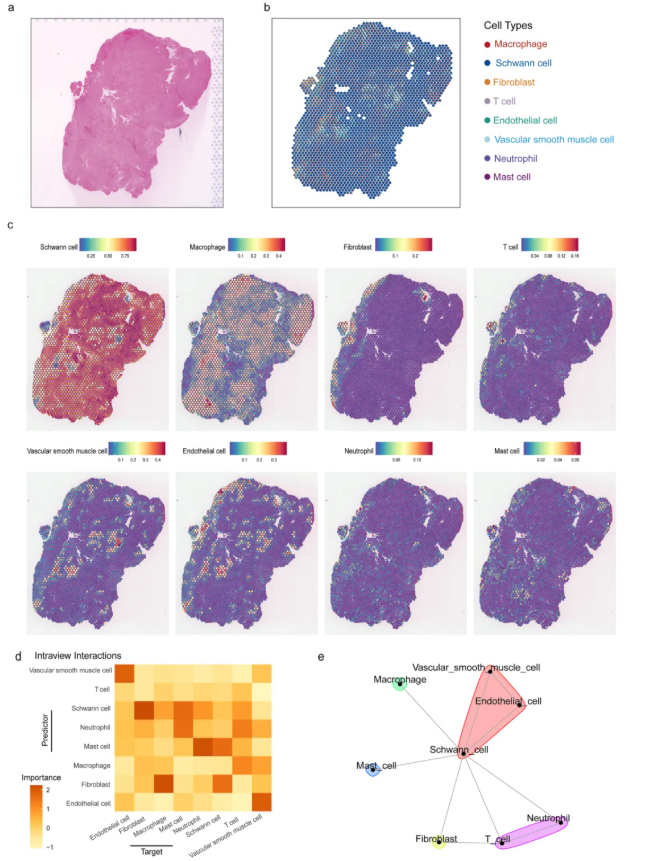
图3. 空间转录组学揭示了VS_S1的转录结构
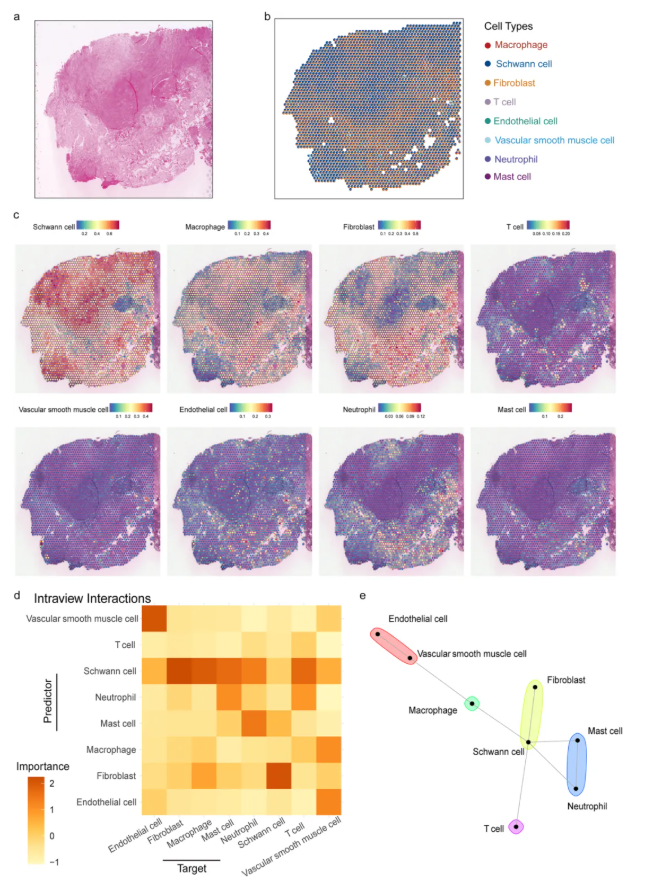
图4. 空间转录组学揭示了VS_S2的转录结构
4、空间生态型表征揭示了前庭神经鞘瘤中的多细胞功能生态位
为识别VS组织中的多细胞群落及其空间分布模式,研究人员基于ISCHIA算法对空间转录组数据中的位点进行聚类分析。根据细胞类型组成的相似性,将空间位点区分为不同的“组成类(composition classes, CCs)”,并将其定义为“空间生态型(spatial ecotypes)”。结合功能富集分析,共鉴定出5种主要的空间生态型(CC1-CC5),每种生态型具有独特的细胞组成和功能特征(图5a-b)。
CC1广泛分布于样本中,且在不同生态型的边界区域相对富集,主要富集轴突再生和神经保护相关的生物学过程;CC2和CC3主要由施万细胞组成,在空间上与Antoni-A型区域一致,分别富集与血管系统发育、神经系统发育及功能连接相关的生物学过程;CC4和CC5与Antoni-B型区域的病理特征相符,分别富集组织发育/修复、屏障形成及炎症调节相关的生物学过程。在样本分布上,CC2和CC3在具有Antoni-A型结构的VS_S1样本中占主导地位;而CC1、CC2和CC5在呈现Antoni-A型与Antoni-B型混合特征的VS_S2样本中均匀分布(图5a)。
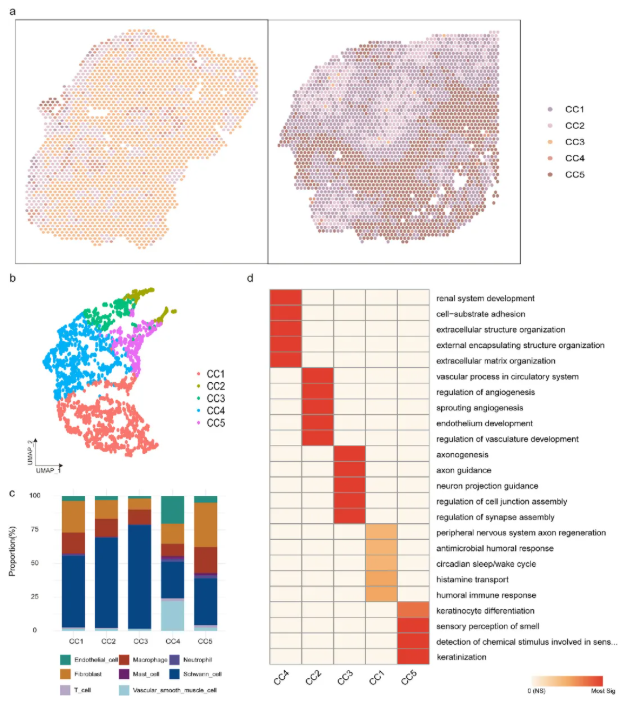
图5. 空间生态型特征揭示了前庭神经鞘瘤中的多细胞功能生态位
5、利用空间转录组学解析前庭神经鞘瘤中施万细胞的结构
为识别区域富集的施万细胞亚型,研究人员基于单细胞RNA测序参考数据,对分子特征不同的施万细胞亚型进行空间注释和定位。结果显示:在VS_S1样本中,JUNB+SCs在部分区域高表达但整体表达较低,PMP2+SCs和NOVhi SCs表达更广泛,PRX+SCs在成纤维细胞表达区域周围局部高表达,而VEGFA+SCs主要位于组织核心区域(图6a-b);在VS_S2样本中,NOVhi SCs高表达区域远离成纤维细胞主导区域,PMP2+SCs和JUNB+SCs的表达区域与组织染色结构特征一致,PRX+SCs和VEGFA+SCs呈局部表达,结合组织背景可见VEGFA+SCs集中于离散区域,可能提示血管生成或血管参与区域(图6a-b)。进一步的空间关联分析显示,VEGFA+SCs的丰度与NOVhi SCs的表达呈显著正相关(图6c-f)。
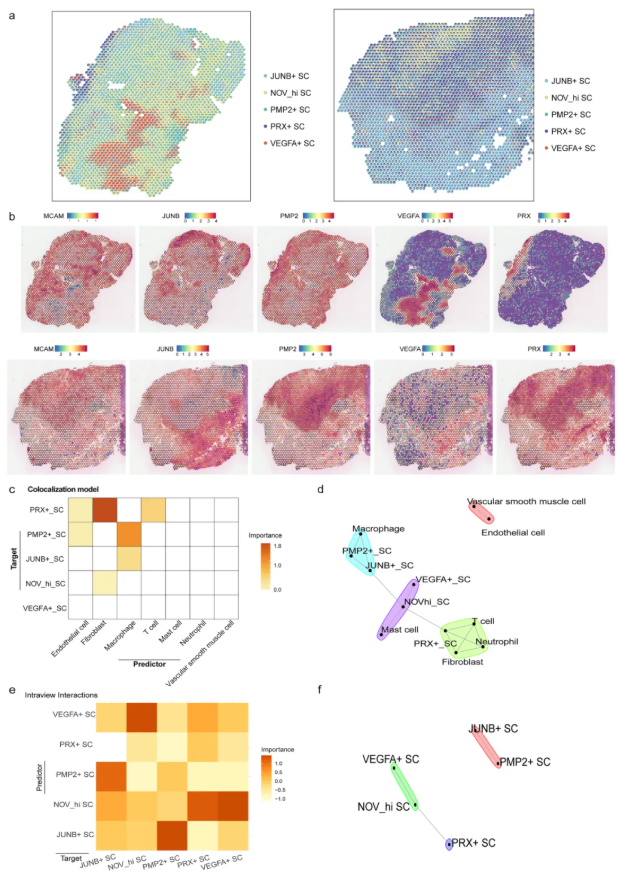
图6. 区域施万细胞亚型的空间识别
6、成纤维细胞与施万细胞之间的通讯可能从多个方面促进前庭神经鞘瘤的进展
研究人员通过CellChat V2分析VS_S2样本,发现施万细胞与成纤维细胞间的PSAP/GPR37L1和SPP1/CD44配体-受体对显著富集(图7a-e),多重免疫荧光染色验证了这一结果,提示其在肿瘤发展中起关键作用。
进一步分析显示,五种施万细胞亚型与成纤维细胞间存在多种配体-受体对,涉及IGF、ANGPTL、CXCL和MDK等信号(图8a-c);成纤维细胞还是FGF、PSAP、MDK和IGF等多个细胞通讯网络的核心(图8d-e),表明两者通讯可能通过多途径促进肿瘤进展。
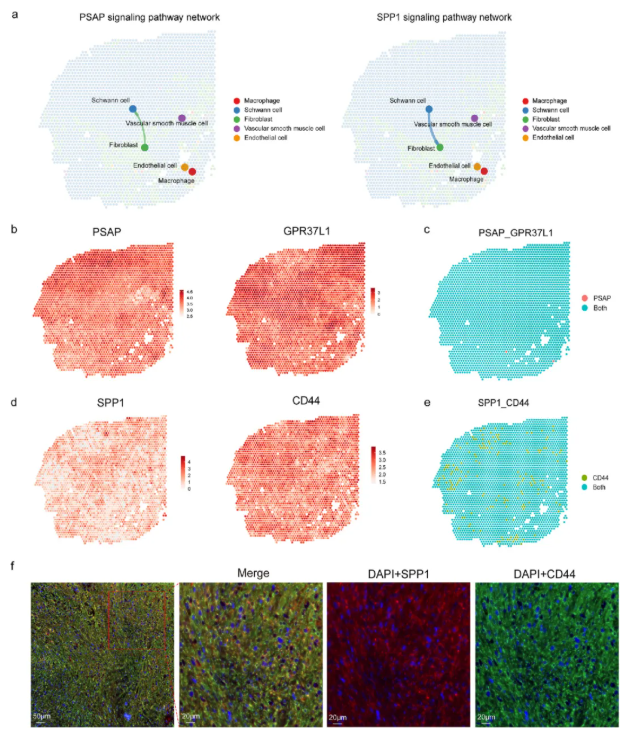
图7. 前庭神经鞘瘤中的细胞配体与受体相互作用
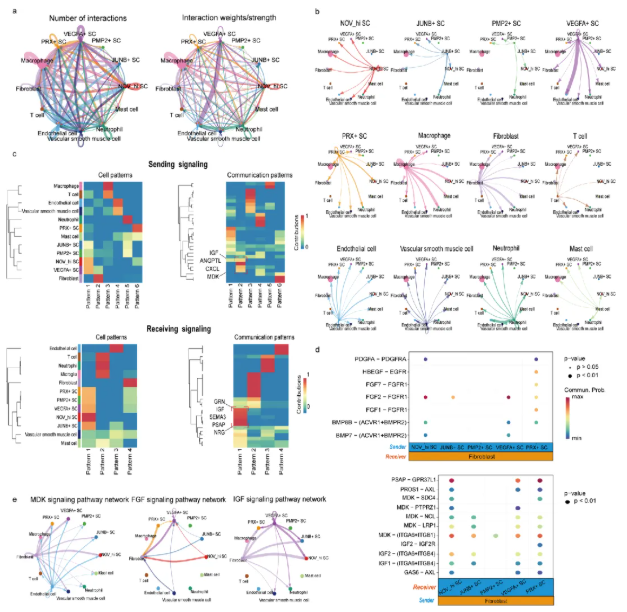
图8. 细胞通讯预测
研究结论
本研究通过整合单细胞RNA测序与空间转录组学技术,系统解析了VS的细胞异质性及空间分布特征。研究鉴定出8种主要细胞群,其中施万细胞存在5种亚型,各亚型在发育、代谢、血管生成等通路中具有特异性功能。空间转录组学揭示了细胞的区域化特征,如VEGFA+SCs定位于肿瘤核心区域,且与NOVhi SCs呈显著共定位;同时识别出5种空间生态型,分别对应Antoni-A型、Antoni-B型等病理结构。此外,细胞通讯分析发现施万细胞与成纤维细胞间通过 PSAP/GPR37L1、SPP1/CD44等配体-受体对及IGF、FGF等信号通路相互作用,提示其在肿瘤进展中的关键作用。这些发现为理解VS的发病机制及开发针对性治疗策略提供了新的分子和空间生物学依据。
单细胞转录组测序,是在单个细胞水平进行高通量测序的技术,能够有效解决细胞异质性,有助于发现新的稀有细胞类型,深入了解细胞生长过程中的表达调控机制。利用微流控系统通过序列标签(barcode和UMI)区别群体中的不同细胞和转录本,获得单细胞水平的基因表达谱。
空间转录组测序,通过对样本包埋切片并与检测芯片结合,利用序列标签(spatial barcode和UMI)区别不同细胞的空间位置,可高效检测组织中空间原始位置上的基因表达模式,两者联合可同时获取细胞类型、功能及空间定位信息。