
英文标题:Bacteroides uniformis-generated hexadecanedioic acid ameliorates metabolic-associated fatty liver disease
中文标题:拟杆菌产生的十六烷二酸可改善代谢相关的脂肪肝疾病
发表期刊:Gut microbes
影响因子:12.2
客户单位:海南医科大学第二附属医院
百趣提供服务:新一代代谢组学NGM 2 Pro、蛋白冠-DIA、宏基因组测序、转录组学、微生物16S扩增子测序
研究背景
代谢相关脂肪肝病(MAFLD)作为一种涵盖从单纯肝脂肪变性到肝硬化、肝癌等多种肝异常的疾病,已成为全球范围内重大的公共卫生挑战。其在全球成人中的患病率超过25%,在中国更是达到约29.2%,严重威胁着人们的肝脏健康乃至生命安全。然而,目前MAFLD的潜在发病机制尚未完全明确,且尚无获批的特效药物用于治疗,这使得深入探究其病理机制并开发新的治疗策略成为当务之急。
肠道菌群作为影响宿主代谢的关键因素,通过产生生物活性代谢物在MAFLD的进展中扮演着重要角色。已有研究表明,肠道菌群失衡可能通过多种途径加剧肝脏脂肪堆积和炎症反应,例如影响脂质吸收、胆汁酸重吸收等。但遗憾的是,对于具体哪种细菌菌株及其代谢产物在MAFLD发病过程中发挥关键作用,目前的认知仍较为有限,多数研究也缺乏机制层面的验证,难以明确因果关系。因此,深入挖掘与MAFLD相关的特定肠道菌群及其代谢产物,并阐明其作用机制,对于推动MAFLD的诊断和治疗具有重要意义。
技术路线
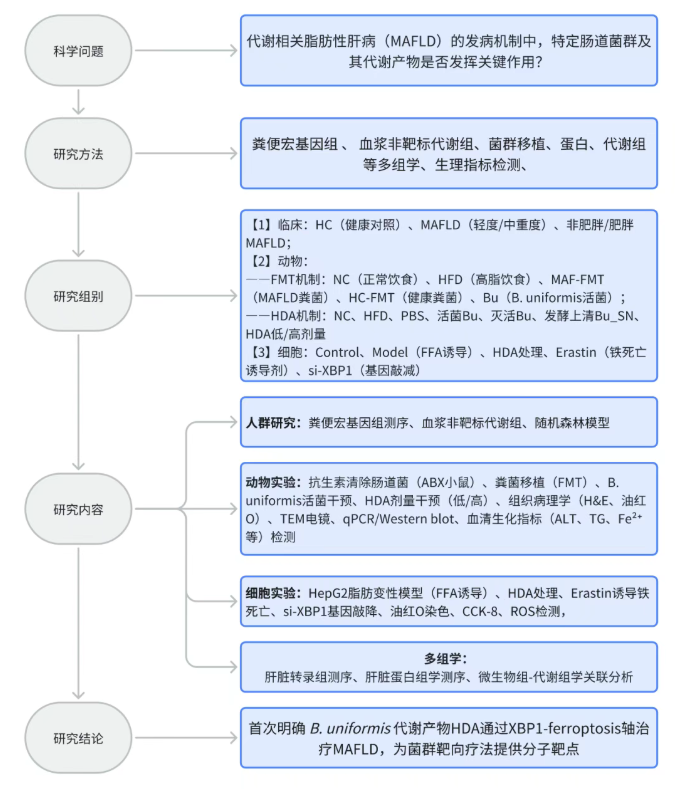
研究结果
1、代谢相关脂肪肝病患者的微生物组特征
研究人员筛选出120名代谢相关脂肪肝病(MAFLD)患者和120名健康对照组(HC)人群,并将其分为以下组别:轻度MAFLD(miMAFLD)和中重度 MAFLD(msMAFLD);非肥胖型MAFLD和肥胖型MAFLD。微生物分析发现,相较于HC,MAFLD组的香农指数(Shannon index)降低(图1a),β多样性差异显著(相似性分析(ANOSIM),图1b);而单形拟杆菌被发现是MAFLD中丰度降低最显著的物种(图1d-f);与此同时,单形拟杆菌与高密度脂蛋白胆固醇(HDL-C)水平呈正相关,与碱性磷酸酶(ALP)呈负相关(图1g)。这些发现表明,微生物代谢通路主要与脂质和氨基酸代谢相关。
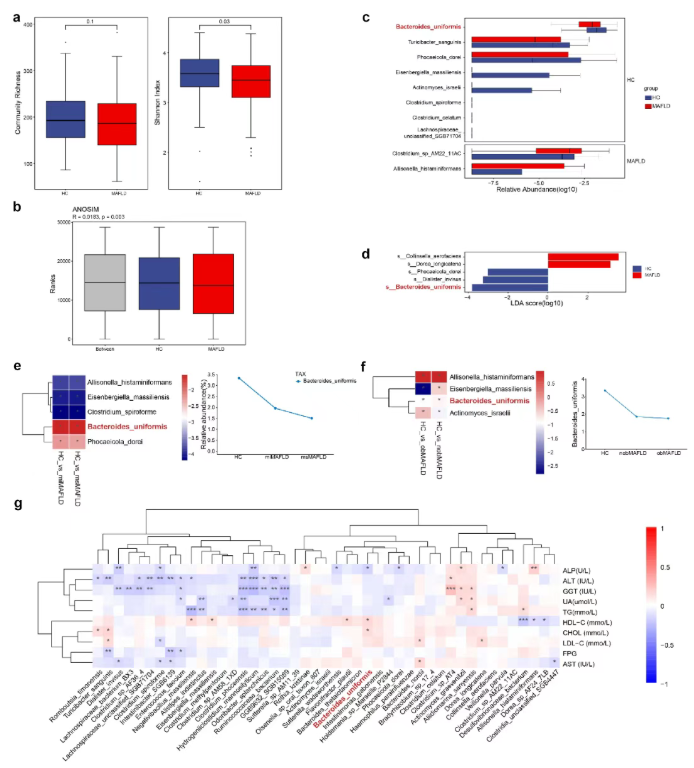
图1. HC和MAFLD患者肠道微生物组的多样性和组成差异
2、代谢相关脂肪肝病患者血中的代谢组学变化
代谢组学分析共鉴定出1800种差异代谢物(图2c),大多数为脂质和类脂质分子,以及有机酸及其衍生物(图2d)。KEGG通路分析显示,多个代谢通路存在显著异常(图2e–f);相较于HC组,MAFLD患者中氨基酸的生物合成和代谢显著上调,而亚油酸代谢和 PPAR信号通路活性显著下调(图2e);按照VIP评分排名筛选出的前10代谢物,与MAFLD的临床指标均具有强相关性(图2g)。前10种微生物物种与前10种差异代谢物相关性分析发现,LysoPC(20:0/0:0)和苯巴比妥与多种微生物物种存在强关联(图2h)。
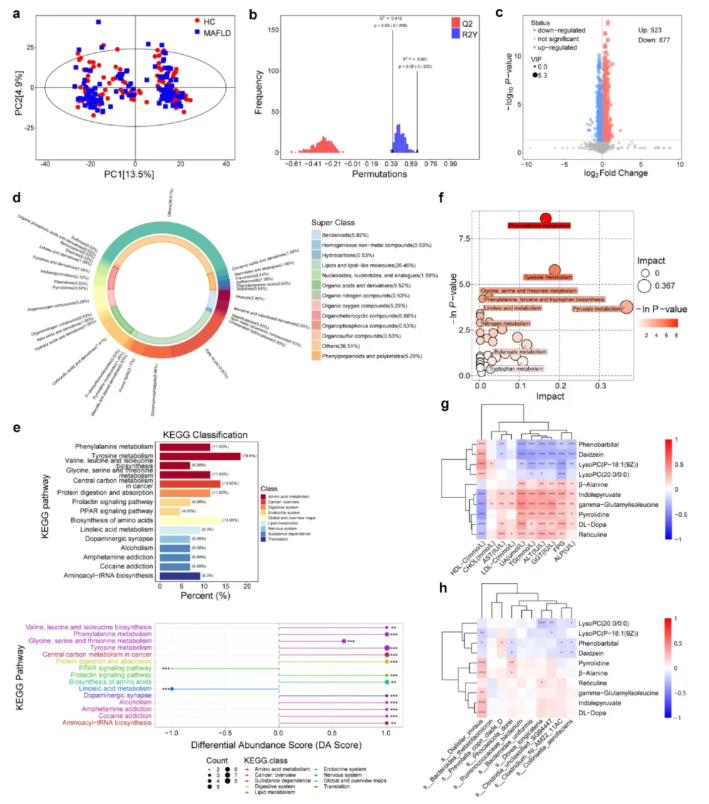
图2. 血清代谢分析显示MAFLD患者与HC相比存在明显改变
3、单形拟杆菌(B. uniformis)能够改善MAFLD小鼠表型
研究构建五组小鼠模型:正常饮食组(NC)、高脂饮食组(HFD)、MAFLD患者粪菌移植组(MAF-FMT)、健康对照粪菌移植组(HC-FMT)、单形拟杆菌干预组(Bu)。其中,接受粪菌移植或Bu干预的小鼠均经抗生素处理为伪无菌模型(ABx小鼠),除NC组外均饲喂高脂饲料(图3a)。
结果显示,与NC组相比,HFD组和MAF-FMT组的体重、肝脏重量、肝脏指数、附睾脂肪重量及指数均显著升高(图3b–f);而HC-FMT组和Bu组上述指标明显降低。组织病理学分析发现,HFD组和MAF-FMT组肝脏存在显著脂肪变性和气球样变,Bu组和HC-FMT组肝脏病理损伤显著减轻,Bu干预效果尤为明显(图3g)
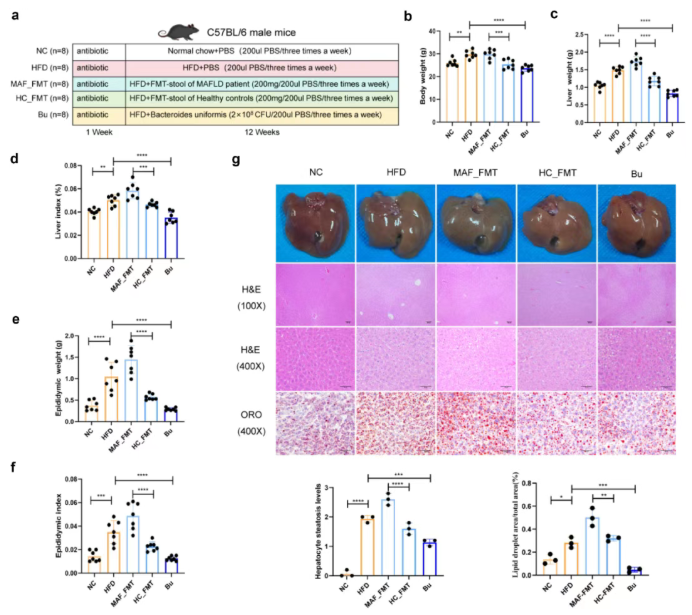
图3. 粪菌移植和B. uniformis补充对高脂饮食诱导的MAFLD小鼠肥胖及肝脏组织病理学的影响
4、B. uniformis通过肠-肝轴抑制IRE1α-XBP1介导的脂肪生成和铁死亡
qPCR和WB实验显示,与NC组相比,HFD组小鼠回肠中脂肪酸转运蛋白CD36和乳糜微粒合成相关因子MTP表达增加(图4a–b),eWAT中脂肪细胞分化调节因子PPARγ及脂肪酸处理蛋白FABP4表达下降(图4c–d),而Bu干预可逆转这些变化(图4a–d)。
肝脏转录组和蛋白质组分析显示,XBP1是调控脂肪生成的关键分子。与HFD组相比,Bu干预显著降低肝脏中磷酸化IRE1α(p-IRE1α)、p-IRE1α/IRE1α比值、剪切型XBP1(XBP1s)、未剪切型XBP1(XBP1u)、XBP1s/XBP1u比值、DGAT2及MTP的表达,并下调血清VLDL水平(图4e–g)。
此外,HFD组小鼠血清Fe²⁺和铁蛋白水平升高,MAF-FMT组更为显著,而HC-FMT和Bu干预可显著降低这些指标,同时改善肝脏铁蓄积、氧化应激及线粒体损伤(图5a–f),qRT-PCR和WB验证了Nrf2/SLC7A11/GPX4通路在其中的作用(图5g–h)。
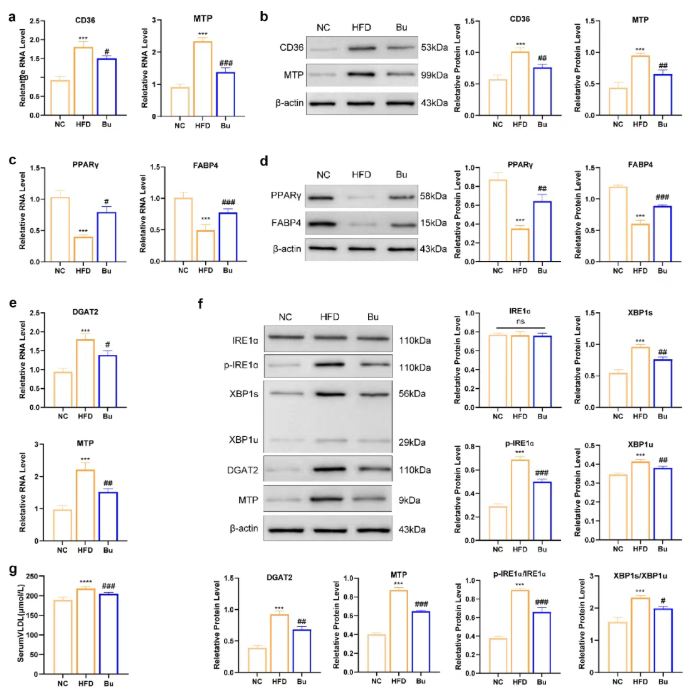
图4. B. uniformis抑制脂肪吸收与转运及IRE1α-XBP1介导的脂肪生成
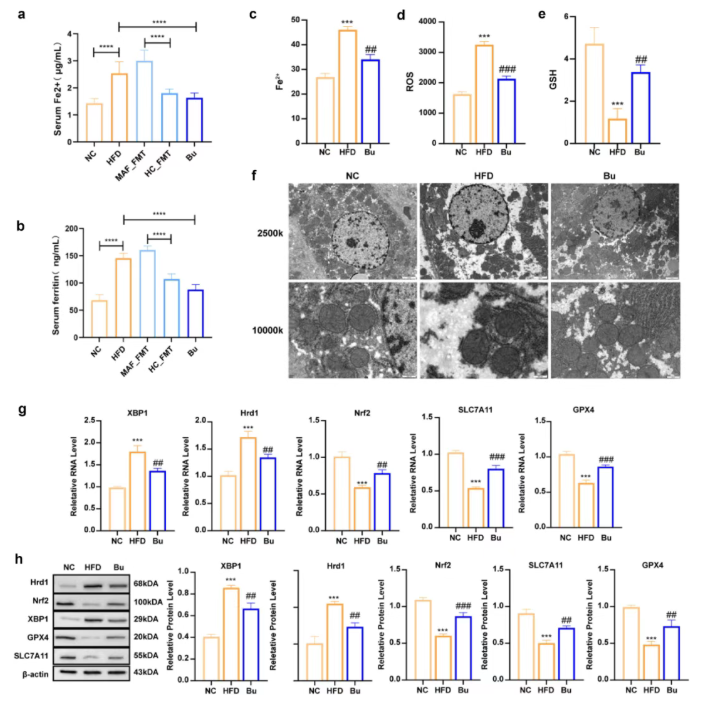
图5. B. uniformis减轻小鼠铁死亡并改善MAFLD进展
5、HDA被鉴定为B. uniformis产生的功能性代谢物
为探究B. uniformis改善MAFLD的代谢机制,研究对灌胃B. uniformis的ABX小鼠粪便、门静脉血清及肝脏组织进行非靶代谢组学分析(图6a-c),同步检测B. uniformis培养上清液,共鉴定出218种显著升高的代谢物(图6d);结合MAFLD患者队列的血清代谢组学数据进行交叉比对,韦恩分析显示,十六烷二酸(HDA)是粪便、门静脉血清、肝脏及细菌上清液中的重叠代谢物,可能通过改善MAFLD症状参与疾病进程(图6e)。进一步研究发现,B. uniformis基因组中存在HDA合成相关基因(EC:3.1.2.14, FASN),提示HDA是其产生的关键功能性代谢物
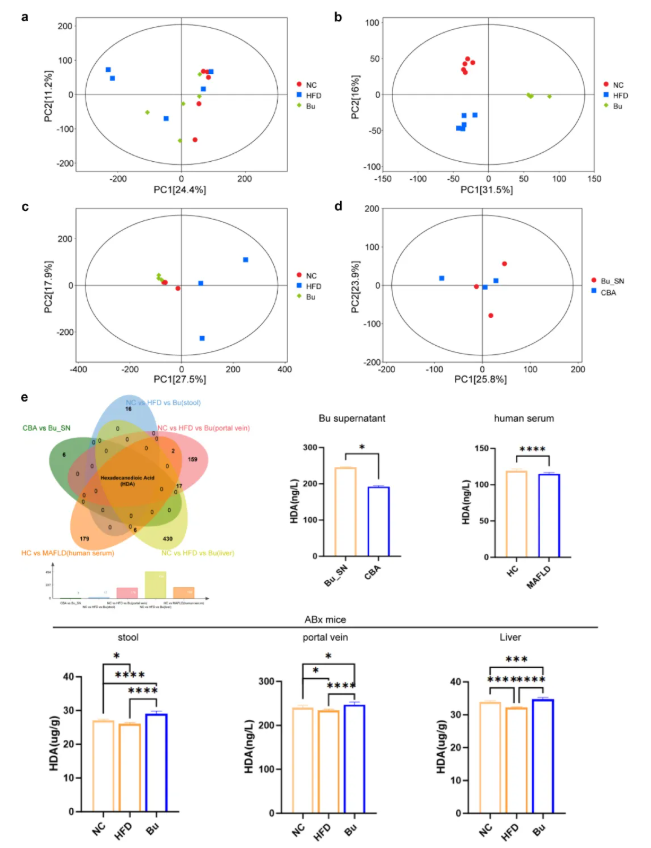
图6. 代谢组学鉴定HDA是介导B. uniformis在MAFLD小鼠中发挥治疗作用的关键生物活性代谢物
6、HDA及XBP1对体外脂质代谢和铁死亡的影响
在游离脂肪酸(FFA)诱导的HepG2脂肪变性模型中,用HDA处理有无铁死亡诱导剂Erastin的细胞。结果显示,与对照组相比,模型组(Mod组)氧化应激显著增强(MDA、ROS、Fe²⁺水平升高,GSH水平降低),并出现铁死亡特征性的线粒体形态改变(图7a);HDA处理可逆转这些变化,同时下调XBP1和Hrd1的表达,上调Nrf2、SLC7A11和GPX4的表达(图7b-c)。
此外,XBP1敲低实验显示,与对照组相比,敲低XBP1后线粒体形态改善,XBP1和Hrd1的表达降低,而Nrf2、SLC7A11和GPX4表达显著上调,同时细胞内脂质积累(TG)和肝功能指标(ALT)降低(图7d-f)。这些结果证实,XBP1在连接B. uniformis产生的HDA与SLC7A11/GPX4铁死亡信号通路中起核心作用。
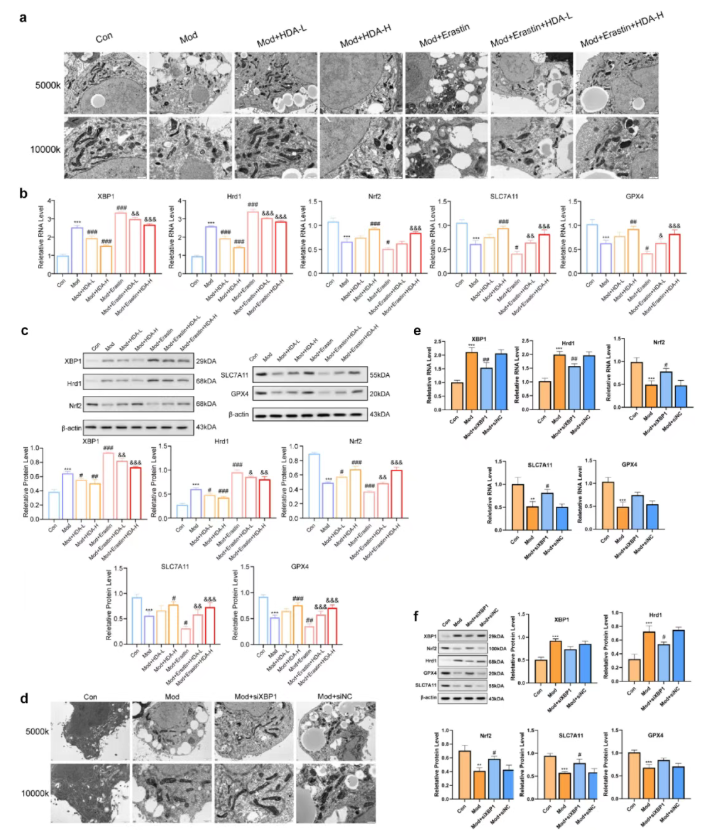
图7. HDA通过XBP1调控减弱MAFLD中的铁死亡
7、在体内,HDA通过Nrf2/SLC7A11/GPX4通路抑制IRE1α-XBP1-Hrd1介导的铁死亡
对MAFLD小鼠进行活的B. uniformis、热灭活B. uniformis、B. uniformis发酵上清(Bu_SN)、哥伦比亚血琼脂(CBA)和HDA处理。结果显示,活的B. uniformis、Bu_SN和HDA干预后,不仅脂肪变性评分和脂滴面积比降低,体重、肝脏重量、肝脏指数及血清AST、ALT、血脂等指标也显著改善;而灭活B. uniformis、CBA或PBS组无明显变化(图8a),表明B. uniformis的抗MAFLD作用主要由其活性代谢物HDA介导。
此外,HDA处理可改善线粒体形态,减少铁死亡相关结构损伤(图8b),并通过下调肝脏XBP1和Hrd1的表达、上调Nrf2、SLC7A11和GPX4的表达,降低血清氧化应激和炎症因子水平,从而抑制MAFLD小鼠的铁死亡(图8c–d)。
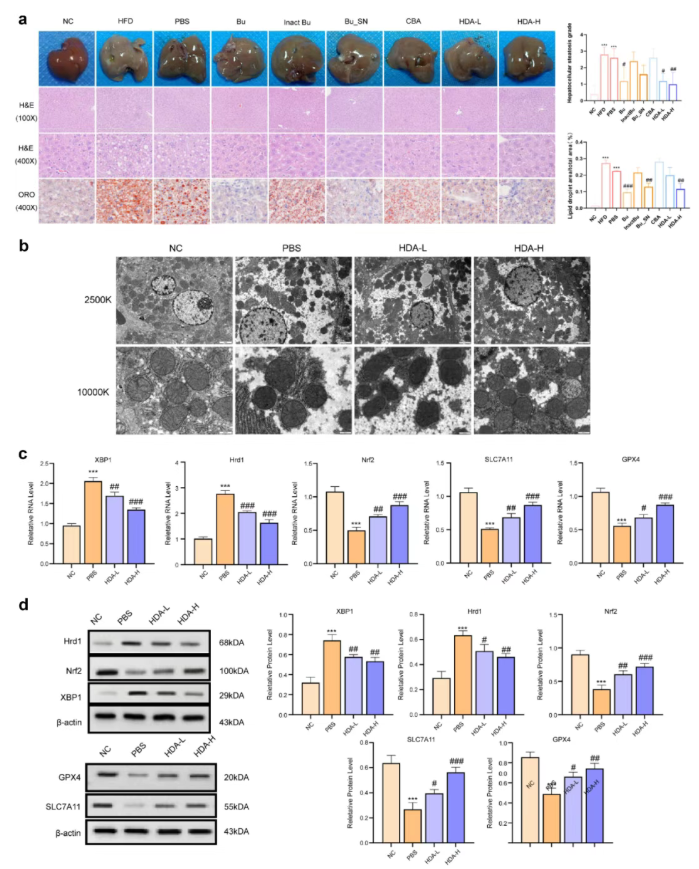
图8. HDA在MAFLD进展过程中减弱MAFLD小鼠肝细胞线粒体铁死亡
8、HDA通过肠-肝轴抑制肠道脂肪吸收及FFA从eWAT流入肝脏,并抑制肝脏XBP1介导的脂肪生成
RT-PCR与WB结果显示,与NC组相比,PBS组回肠组织中CD36、MTP及肝脏中DGAT2的mRNA和蛋白表达上调(图9a-b),eWAT中PPARγ、FABP4的mRNA和蛋白表达下调(图9c-d);此外,HDA下调了PBS组回肠中p-IRE1α/IRE1α比值、剪切型XBP1(XBP1s)、未剪切型XBP1(XBP1u)、XBP1s/XBP1u比值及肝脏中DGAT2、MTP的表达水平(图9e-f),并降低了高脂饮食喂养小鼠的血清VLDL水平(图9g),验证了HDA通过肠-肝轴抑制脂肪吸收和生成的作用。
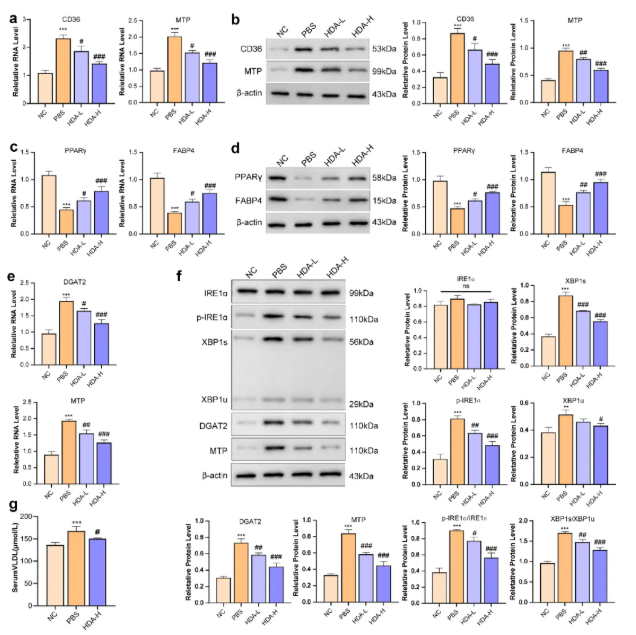
图9. HDA抑制脂肪吸收与转运及IRE1α-XBP1介导的脂肪生成
研究总结
该研究探究了单形拟杆菌(B. uniformis)及其代谢物HDA通过以下方式调节MAFLD进展:抑制肠道脂肪吸收、通过肠-肝轴减少游离脂肪酸(FFA)从附睾白色脂肪组织(eWAT)流入肝脏、调节IRE1α-XBP1s轴抑制肝脏脂肪生成,以及通过Nrf2/SLC7A11/GPX4通路抑制铁死亡。
未来的研究应进一步评估B. uniformis和HDA的临床潜力,尤其是在不同MAFLD分期患者中改善肝功能、调节代谢稳态的作用。此外,将B. uniformis与饮食干预、药物治疗等策略结合,可能增强其在MAFLD管理中的疗效,为患者提供更全面的治疗选择。
百趣生物新一代代谢组学NGM 2 Pro,凭借全球领先的 2w+ 代谢物标准品自建库,显著改善代谢组学鉴定准确性不足、数量有限的痛点。其基于LC-MS技术,可检测生物受刺激后小分子代谢物动态变化,助力筛选差异代谢物并关联生理病理。针对代谢物多样性及提取局限,该技术通过多色谱柱联用覆盖非极性/极性代谢物与脂质,结合标准品自建库进一步提升鉴定效率,为标志物筛选、机制研究提供有力支撑。
蛋白冠-DIA,采用数据非依赖采集(DIA)模式对每例实验样本进行检测。该模式在预设扫描窗口内实现所有母离子的二级碎裂,具有高重现性优势,可获取更丰富的谱图信息,从而提升定性定量结果的覆盖度与可靠性。百趣推出的蛋白冠-DIA蛋白质组学解决方案,采用磁珠法进行样本前处理,并整合自动化前处理设备。此方案通过对所有蛋白质的无偏向性吸附,不仅确保鉴定结果的稳定性与一致性,同时显著降低对生物样本量的需求,为微量样本的蛋白质组学分析提供了高效可靠的技术支持。
宏基因组测序,利用新一代高通量测序技术,以特定环境中微生物群体的全部基因组为研究对象,在解析微生物多样性、种群结构及进化关系的基础上,进一步探究微生物群体的功能活性、种间协作机制及与环境的互作关系,从而发掘其潜在的生物学价值。与传统微生物研究方法相比,宏基因组测序技术规避了传统方法中绝大部分微生物难以纯培养、痕量菌群无法有效检测的技术局限。
转录组学,对细胞或组织在某一状态下的全部RNA进行测定,凭借新一代高通量测序技术,它能快速获取海量转录本序列,精准识别可变剪接、新转录本等关键信息。无论是助力基础研究探索基因功能,还是为临床诊断提供分子层面依据,转录组测序都是强有力的科研工具,为解锁生命奥秘、攻克健康难题带来更多可能。
微生物16S扩增子测序,基于二代测序平台靶向扩增微生物16S rRNA基因可变区,可高效解析样本中细菌/古菌的群落组成、物种丰度及分布差异;其通过提取样本总DNA、靶向扩增目标片段、高通量测序等关键步骤快速获取菌群结构信息,广泛应用于肠道、土壤等各类含微生物样本研究,能为探究微生物与环境、宿主的互作关系(如肠道菌群与疾病、土壤菌群与作物生长)提供关键数据支撑。