英文标题:Personalized molecular signatures of insulin resistance and type 2 diabetes
中文标题:胰岛素抵抗和2型糖尿病的个性化分子特征
发表期刊:Cell
影响因子:42.5
研究背景
2型糖尿病是全球范围内日益严峻的健康挑战,目前全球患者已超过5亿。该疾病以空腹或餐后血糖水平升高以及外周胰岛素抵抗为主要特征,其中骨骼肌是胰岛素刺激葡萄糖摄取的主要组织,也是2型糖尿病中胰岛素抵抗的关键部位。然而,2型糖尿病具有高度异质性,其病理机制复杂,受遗传和环境等多种因素影响,不同亚型的疾病进展和临床结局存在差异。
尽管过去几十年对胰岛素调节葡萄糖摄取的机制及胰岛素抵抗的相关位点已有较多研究,但多为针对特定分子的研究,缺乏对骨骼肌胰岛素信号的全面系统探究,且个体间胰岛素信号的差异如何导致疾病异质性仍是未解之谜。同时,基于质谱的蛋白质组学技术已在癌症等领域的精准医疗中展现出潜力,但针对胰岛素抵抗相关组织(如骨骼肌)的大样本量蛋白质组学研究较为缺乏,限制了2型糖尿病针对性治疗策略的发展。
因此,深入解析胰岛素抵抗的分子特征,明确其与个体表型的关联,对于推动2型糖尿病的精准诊疗具有重要意义。
研究结果
1、人类骨骼肌的蛋白质组和磷酸化蛋白质组是全身胰岛素敏感性的关键决定因素
为探究胰岛素抵抗和2型糖尿病的分子图谱,研究设置了发现队列(77人,含34名2型糖尿病患者和43名糖耐量正常者)和验证队列(46人,含34名2型糖尿病患者和12名糖耐量正常者),并对所有参与者进行体内血糖表型分析及骨骼肌活检样本采集(图1A)。结果显示,2型糖尿病患者的空腹血糖等指标升高、M值降低,且各队列胰岛素敏感性存在显著异质性(图1B-C)。
基于此,研究开发高通量样本制备流程,结合质谱技术分析骨骼肌蛋白质组和磷酸化蛋白质组,覆盖 3038种蛋白质、3000种磷酸化蛋白质上的29165个磷酸位点,验证队列覆盖率与发现队列相当,且数据变异多源于生物学因素,可靠性经验证(图1D-G)。
主成分分析表明,蛋白质组和磷酸化蛋白质组在胰岛素敏感性状态上呈连续分布,胰岛素敏感性对其累积主成分方差贡献最大,且两者对胰岛素敏感性状态的预测能力优于临床疾病分组(图1H-K)。相关性分析显示,骨骼肌蛋白质组与胰岛素依赖性临床指标关联最强,磷酸化蛋白质组与M值关联更显著;多维标度分析发现同一诊断组内存在聚类和个体间异质性(图1L)。
综上,骨骼肌蛋白质组和磷酸化蛋白质组在全身胰岛素敏感性中起关键作用,为理解疾病异质性提供了分子层面的依据。
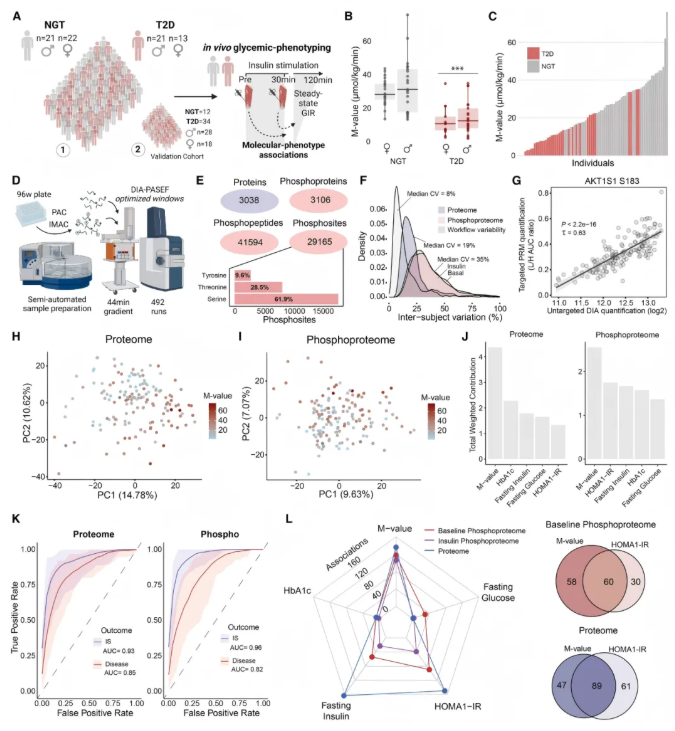
图1. 人类骨骼肌的蛋白质组和磷酸化蛋白质组是全身胰岛素敏感性的关键决定因素
2、人类骨骼肌中胰岛素敏感性的蛋白质组特征
研究通过分析发现队列和验证队列,探究蛋白质丰度与全身胰岛素敏感性的关系,发现空腹状态下蛋白质丰度与胰岛素敏感性存在136种关联(图2A),其中HSPA2呈强负相关、BDH1呈强正相关,且验证队列89%变化方向一致;2型糖尿病患者与糖耐量正常者仅15种差异蛋白质,诊断组内异质性显著。
与胰岛素敏感性正相关的蛋白质涉及氧化磷酸化等通路(图2B),负相关的则涉及蛋白水解等过程。不同诊断组线粒体总蛋白丰度无显著差异(图2C),但与胰岛素敏感性相关(图2D),校正后ATP合成酶复合物与胰岛素敏感性相关性最强(图2E)。
LDH同工酶在诊断组间调节方向相反,与胰岛素敏感性关联趋势相反(图2A),LDHA/LDHB比例与胰岛素敏感性强相关(图2F)。胰岛素敏感性高的人氧化磷酸化蛋白占比增加(图2G),糖酵解蛋白占比减少,且两者比值与胰岛素敏感性负相关(图2H)。
综上,研究揭示了与胰岛素敏感性相关的通路及代谢特征变化,强调基于连续代谢指标开展诊断和治疗的必要性。
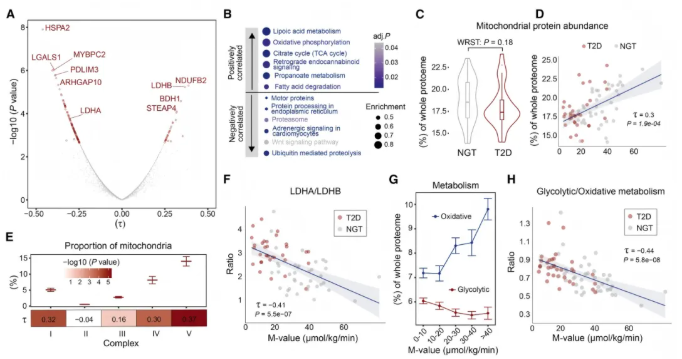
图2. 胰岛素敏感型和胰岛素抵抗型骨骼肌的蛋白质组特征
3、空腹状态下的磷酸化蛋白质组图谱是胰岛素敏感性的关键决定因素
研究对比空腹状态下2型糖尿病患者与糖耐量正常者的骨骼肌,发现43个磷酸位点状态改变,如VPS13B的S206磷酸化上调、ADD1的S358磷酸化下调;与胰岛素信号相关的激酶活性在2型糖尿病患者中下调,而TGF-β和BMP信号相关激酶活性上调。
受空腹状态蛋白质与胰岛素敏感性关联的启发,研究发现空腹状态有118个磷酸位点、胰岛素刺激状态有66个磷酸位点与胰岛素敏感性相关(图3A),且93%的空腹关联在验证队列中方向一致。部分磷酸位点与胰岛素敏感性相关但母蛋白无此关联(图3B),激酶富集分析显示JNK和p38家族激酶激活与胰岛素抵抗相关(图3C)。
AMPK调节亚基3的S65与胰岛素抵抗相关性最强(图3D),该发现在验证队列中得到证实,且该位点为人类特有(图3F),MAPKAPK2是其上游调节因子(图3G-I)。沉默AMPKγ3表达可改善胰岛素作用(图3J-K),其差异调节蛋白富集于多个相关通路(图3L-M),但S65磷酸化的具体功能意义尚不明确。
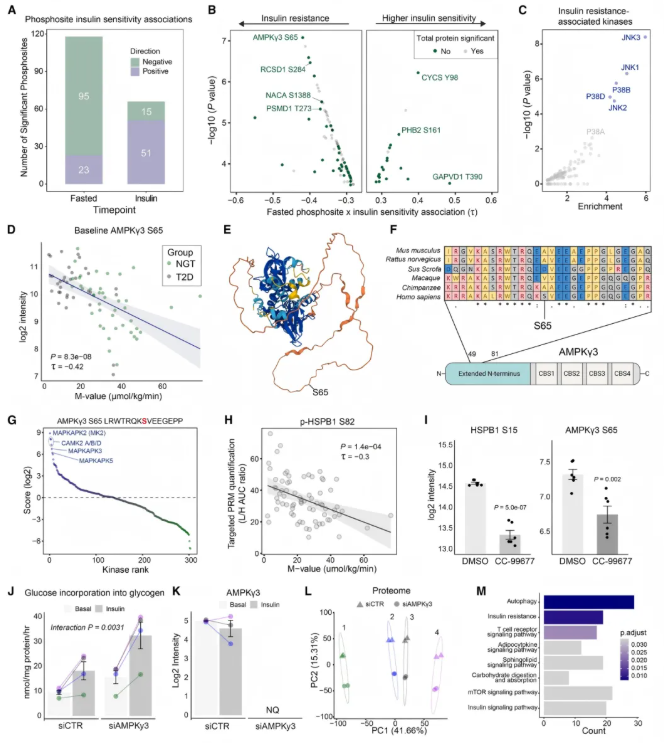
图3. 空腹状态下的磷酸化蛋白质组图谱是胰岛素敏感性(IS)的关键决定因素
4、胰岛素抵抗状态下胰岛素信号的保留与失调
研究发现,30分钟胰岛素刺激后有243个磷酸位点受调控(图4A),包括经典胰岛素信号蛋白(如 TBC1D4 S341、AKT1S1 T246、TSC2 T1462)及研究较少的蛋白(如PATL1 T194),靶标定量验证了部分位点的胰岛素刺激增加。
受调控位点富集于蛋白调控功能,激酶富集分析显示经典胰岛素激活激酶(PDK1、mTOR等)及新发现的激酶(DCLK1、CDK家族等)被激活(图4B-C)。
通过分层方法确定5组与胰岛素敏感性相关的磷酸位点,最大组随胰岛素敏感性增加,磷酸化水平逐步升高(图4D);66个位点在胰岛素刺激下与胰岛素敏感性相关(54个正相关,12个负相关)(图4E)。TNS2 S120磷酸化仅在胰岛素刺激后与胰岛素敏感性正相关(图4F),而IRS1 Y612磷酸化无关;AMPKα2 S377和RPTOR S863磷酸化与胰岛素敏感性正相关,且其空腹磷酸化与胰岛素敏感性无关(图4E)。
胰岛素刺激的磷酸位点与胰岛素敏感性关联差异大(图4G),AKT部分底物(如GSK3B S9、TBC1D4 T642)与胰岛素敏感性关联弱但对胰岛素有反应(图4G-H),靶标定量验证了AKT靶标保留的胰岛素信号;mTOR底物(如EIF4EBP1 T70、RPTOR S863)与胰岛素敏感性高度相关(图4I),凸显胰岛素抵抗中信号通路失调的复杂性。
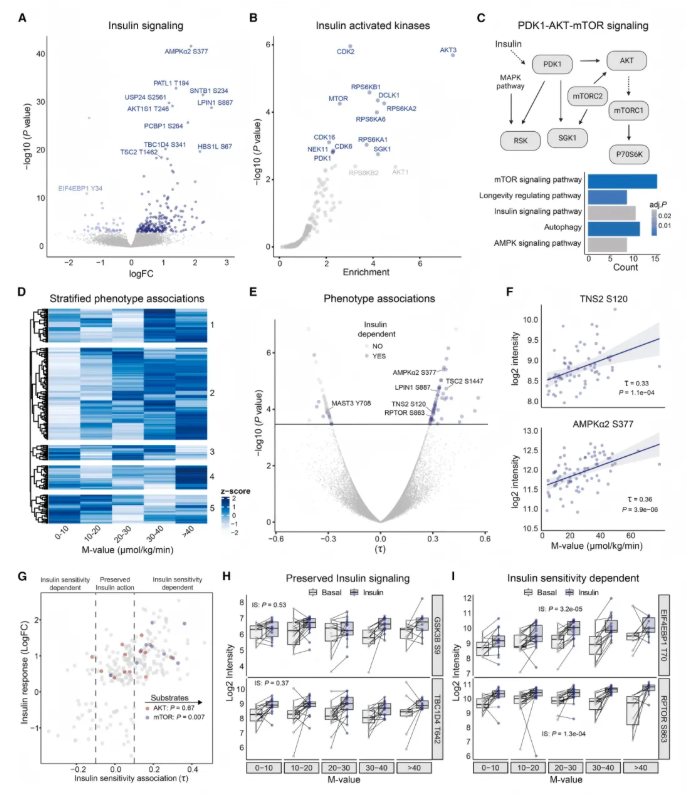
图4. 胰岛素抵抗状态下胰岛素信号的保留与失调
5、性别特异性分子特征揭示了代谢的共有特征与独特特征
研究阐明了男性与女性骨骼肌的独特分子特征,提供了按性别区分的蛋白质组和磷酸化蛋白质组图谱。队列中女性均为绝经后/围绝经期,主成分分析显示男女在磷酸化蛋白质组和蛋白质组上明显分离,且110种蛋白质和343个磷酸位点存在性别差异调节(图5A-B),验证队列中92%的性别特异性蛋白质和81%的性别特异性磷酸位点变化方向一致。
男性中与葡萄糖代谢和氧化磷酸化相关的蛋白质富集,女性中与脂质摄取/储存相关的蛋白质含量更高(图5C);性别相关磷酸位点位于信号蛋白上,如女性多聚泛素-B(UBB)的S57磷酸化更高,磷酸化蛋白质组分析显示激酶存在性别特异性富集(图5D),强调研究设计和临床试验需考虑性别因素。
一小部分性别特异性蛋白质和磷酸化蛋白质位于X染色体上(图5E),110种差异表达蛋白质中仅7种为X染色体编码,表明性别差异主要取决于常染色体和激素调节。
尽管蛋白质组和磷酸化蛋白质组存在性别差异,但绝大多数胰岛素反应性磷酸位点的胰岛素反应在男女间可比(图5F),性别并非蛋白质或磷酸位点与胰岛素敏感性关联的重要修饰因素,且男女中氧化酶和糖酵解酶丰度均与胰岛素敏感性高度相关,说明男女骨骼肌中胰岛素作用和抵抗的分子转导因子相似。
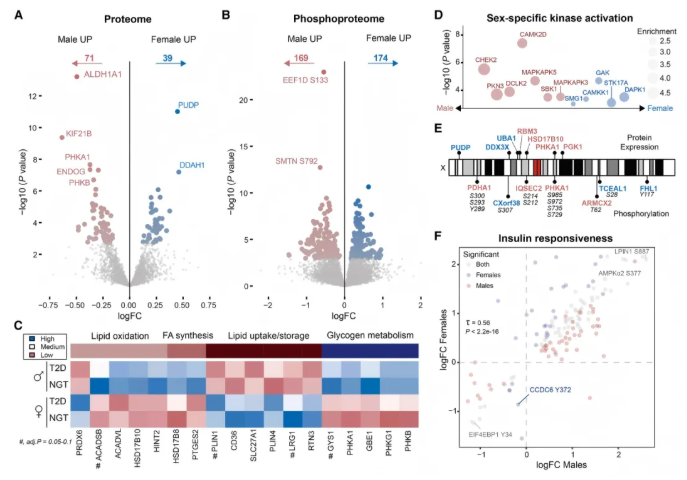
图5. 性别特异性分子特征揭示了代谢的共有特征与独特特征
研究结论
本研究围绕骨骼肌蛋白质组和磷酸化蛋白质组展开,探究其与胰岛素敏感性、胰岛素抵抗及性别差异的关联。研究发现,空腹及胰岛素刺激状态下,多个磷酸位点与胰岛素敏感性相关,如空腹状态有118个、胰岛素刺激状态有66个,且部分磷酸位点的关联独立于母蛋白;与胰岛素信号相关的激酶在2型糖尿病患者中活性下调,而TGF-β等信号相关激酶活性上调,JNK-p38通路等在胰岛素抵抗中起重要作用。同时,性别特异性分子特征显著,男女在蛋白质组和磷酸化蛋白质组上存在差异,涉及代谢相关蛋白及激酶,但胰岛素作用和抵抗的分子转导因子在男女中相似。这些结果为理解胰岛素抵抗机制及考虑性别因素的研究和临床实践提供了重要依据。
磷酸化修饰蛋白组学:蛋白质磷酸化是由蛋白质激酶催化的把ATP的磷酸基转移到底物蛋白质氨基酸残基(Ser, Thr, Tyr)上的过程,是生物体内一种普通的调节方式,细胞内有超过30%的蛋白质发生磷酸化修饰,在细胞信号转导、调控细胞增殖、发育、分化、凋亡过程中起重要作用。蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍,也是最重要的机制。