
英文标题:An adaptive, continuous-learning framework for clinical decision-making from proteome-wide biofluid data
中文标题:一种基于全蛋白质组生物流体数据的自适应持续学习临床决策框架
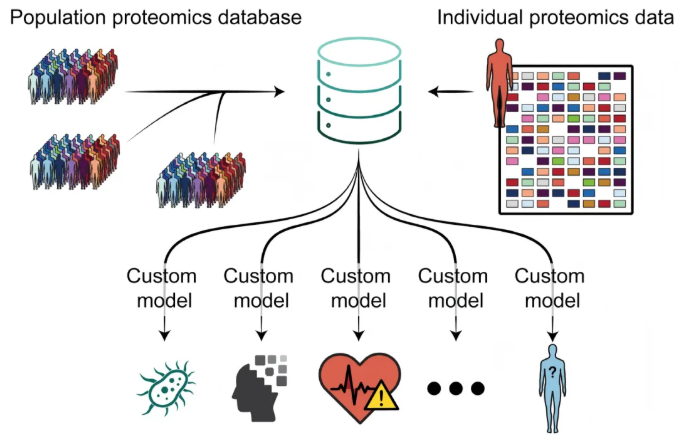
在精准医疗需求日益迫切的当下,如何将发现型蛋白质组学从“研究工具”转化为“常规临床诊断手段”,是生物医学领域的关键命题。本文围绕ADAPT-MS自适应框架展开解读,通过脓毒症血浆蛋白质组队列(发现队列902例、验证队列459例)、阿尔茨海默病脑脊液蛋白质组队列等多场景验证表明:ADAPT-MS突破了传统诊断流程的局限,仅需利用全蛋白质组数据,即可通过“动态重训练”实现样本特异性诊断,且在高缺失值样本、跨中心场景中均保持稳定性能。这些研究结果不仅验证了ADAPT-MS框架的临床适用性,更核心的是证明——以血浆、脑脊液为代表的生物流体蛋白质组学,能够通过适配的技术框架高效衔接分子特征与临床决策,充分凸显其作为灵活、精准、稳健临床诊断工具的核心价值,为蛋白质组学的临床转化提供了可行路径。
研究背景
基于质谱(MS)的蛋白质组学技术,凭借单次检测量化生物流体样本中数千种蛋白质的能力,为解析全身性疾病进程、监测健康状态提供深度分子视角,在血浆、脑脊液等样本分析中,展现出推动临床诊断革新的潜力,是生物医学领域揭示疾病机制、挖掘诊疗靶点与生物标志物的关键工具。
然而,该技术长期受限于多重壁垒,难以从“研究工具”转化为“常规诊断手段”:数据层面,发现型蛋白质组学存在随机/非随机缺失值(如数据依赖采集workflow中低丰度蛋白遗漏),常规机器学习依赖完整矩阵,插补策略易引入偏差;流程层面,传统生物标志物开发需“队列构建—差异筛选—候选生物标志物集合—靶向验证”,耗时耗资源,大量全蛋白质组数据因聚焦少量标志物被丢弃;功能层面,固定面板仅能解答单一诊断问题,无法适配临床复杂场景;技术规范层面,蛋白质定量多为相对值,缺乏群体参考范围,临床实验室也缺乏解读大规模组学数据的能力。
近年来,样本制备、仪器性能与数据处理的优化,实现了高通量、稳健的生物流体蛋白质组学分析,population-scale蛋白质组学数据集(含临床表型注释)持续积累;同时临床需求向“多维度、快速化、假设灵活”转变,亟需能直接从全蛋白质组数据输出诊断结论的工具。在此背景下,突破蛋白质组学临床应用瓶颈,构建衔接发现型数据与临床决策的技术框架,成为推动其向常规临床工具转化的关键方向。
技术路线
研究结果
1、ADAPT-MS框架的构建
传统蛋白质组学诊断流程遵循“发现-验证-靶向应用”的刚性模式:先在病例对照队列筛选候选生物标志物,转化为ELISA等靶向检测方法,最终仅能针对单一诊断问题应用于新患者(图1A)。该流程虽靠靶向检测确保数据完整,但存在灵活性低、丢弃大量蛋白质组数据、仅能解决单一诊断需求的局限。
若直接将发现型蛋白质组数据用于诊断,又会因数据矩阵不完整(如低丰度蛋白半随机缺失)导致分类模型性能下降,虽可通过插补或数据协调处理,但易引入偏差影响诊断可靠性(图1B)。
本文提出的ADAPT-MS框架(图1C),通过“动态重训练”突破数据缺失瓶颈:先从训练数据生成“宽松特征集”;针对每个测试样本,筛选其实际定量蛋白质与“宽松特征集”的交集作为定制特征;再用原始发现数据重训练逻辑回归等分类模型,实现样本特异性诊断,全程无需数据插补,可直接利用发现型蛋白质组数据完成单样本分类。
针对新诊断需求,ADAPT-MS无需开展新前瞻性研究,仅通过样本元数据(如年龄、性别、合并症、采样背景)从大型蛋白质组数据库 “回顾性筛选匹配训练队列”,在该子集完成特征选择与模型训练,最终实现个性化诊断。这种模式将传统“一个诊断问题对应一套候选生物标志物组合”范式转化为“可复用的灵活诊断基础设施”,支持从同一样本蛋白质组数据提取多个诊断结论,大幅提升数据利用效率与诊断灵活性(图1D)。
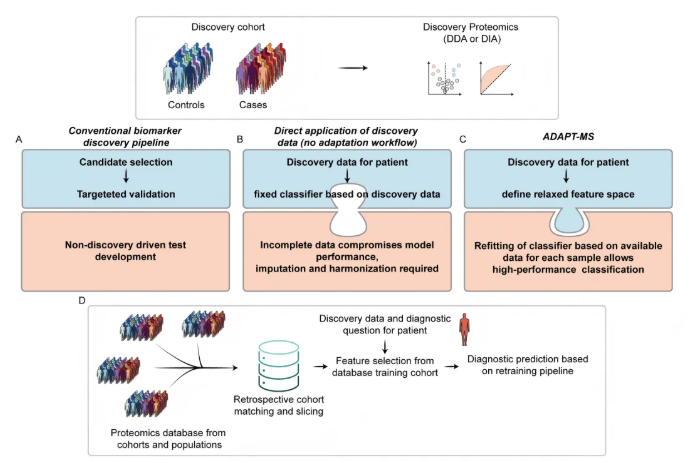
图1. ADAPT-MS与传统生物标志物处理框架对比
2、脓毒症血浆蛋白质组学队列的动态再训练
ADAPT-MS框架在脓毒症血浆蛋白质组诊断中的性能表现,是验证其临床适用性的关键环节。为探究该框架在真实临床数据中的诊断能力与优势,研究团队以Roman Fisher团队发表的脓毒症血浆蛋白质组数据集为对象,设置发现队列(902例样本)与验证队列(459例样本),所有样本均采用高通量数据依赖采集(DDA)的PASEF模式检测。结果显示,该数据集存在发现型蛋白质组的典型问题——低丰度蛋白呈半随机缺失;传统“随机森林特征选择+XGBoost分类”流程在验证集的ROC曲线下面积(AUC)为0.83,而ADAPT-MS无需缺失值插补,在验证集的AUC达0.87,性能更优,且在高缺失值样本中仍保持稳定(图2A-B)。从核心机制来看,传统模型依赖完整数据与固定特征,数据缺失直接导致性能下降;ADAPT-MS则从发现队列生成“宽松特征集”,针对单个测试样本筛选其实际定量蛋白质与“宽松特征集”的交集作为定制特征,再用原始发现数据重训练模型,从而规避了数据插补环节(图2A-B)。此外,研究团队还对比了ADAPT-MS与传统模型在不同训练样本量下的性能变化。从结果中可以看出,随着样本量的增加,两类模型的AUC均逐步提升,但ADAPT-MS在各样本量下的性能均与传统模型相当的情况下,能在更小的样本量时仍维持较高的AUC(图2C),这意味着在临床应用中数据积累的门槛能够得以降低!
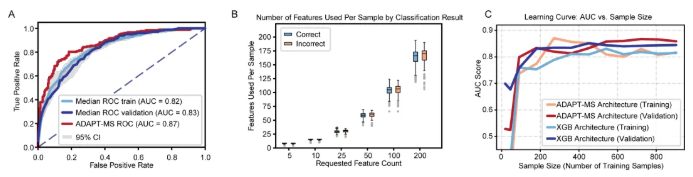
图2. ADAPT-MS对脓毒症队列血浆蛋白质组学数据的应用
3、ADAPT-MS在多中心临床场景下的泛化能力
研究团队将验证拓展至阿尔茨海默病(AD)多中心脑脊液(CSF)蛋白质组领域,核心验证该框架在跨中心数据异质性下的泛化能力。结果显示:瑞典、柏林、马格德堡/基尔3个亚组中,瑞典与马格德堡/基尔亚组的AD与非AD样本蛋白质组特征差异显著、可清晰分离;柏林亚组因临床异质性,AD与非AD样本蛋白质组特征出现明显重叠,成为验证跨中心数据适配能力的关键“挑战队列”。ADAPT-MS以瑞典亚组为发现队列时,在马格德堡/基尔亚组的AD鉴别AUC达0.85、柏林亚组达0.73,合并瑞典+马格德堡/基尔数据后柏林亚组AUC进一步提升至0.80,证实多中心整合可优化性能(图3A)。采用“从3个临床中心抽取均衡样本构建训练集”的策略后,ADAPT-MS在3个亚组的分类AUC均稳定超0.80,有效规避单一中心数据偏倚,凸显框架整合异质性数据源的灵活性(图3B)。
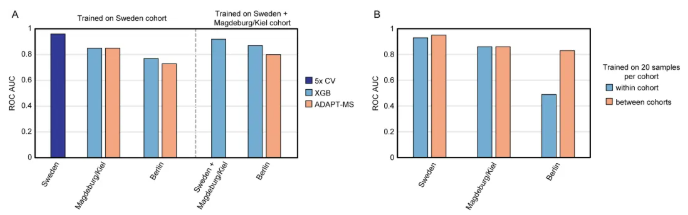
图3. ADAPT-MS在AD的多中心脑脊液蛋白质组学研究中实现稳健的跨中心分类
4、回顾性队列匹配提高了模拟诊断中的分类性能
为评估ADAPT-MS的回顾性队列选择功能,研究团队再次使用之前的脓毒症蛋白质组学数据集。他们根据患者元数据(如年龄、性别、合并症等),从已有数据中筛选出特征相似的样本组成新的训练队列,不用为每个诊断任务重新招募患者、采集新样本开展研究(图4A);最终能针对不同临床需求输出定制化诊断结果,可同时支持脓毒症与非脓毒症分类、脓毒症SRS(转录组定义的脓毒症反应特征)分组、脓毒症SPC(蛋白质组聚类定义的亚型)分组三类诊断任务,打破“一次检测只能解决一个诊断问题”的局限。
数据结果显示:图4B(ROC曲线)AUC达0.99,能极精准识别脓毒症患者,为急诊快速分诊提供支撑;图4C(ROC曲线)AUC 0.87,可精准区分SRS特征脓毒症患者,助力个性化干预;图4D(3条ROC曲线)区分SPC1/SPC2/SPC3亚型,AUC均达0.93以上,验证其对多类别细分诊断的适配能力,为解析脓毒症异质性提供关键工具。
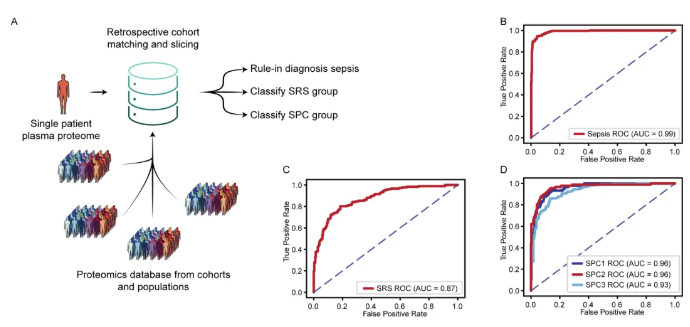
图4. 回顾性队列匹配
研究结论
本研究围绕ADAPT-MS展开,旨在突破传统发现型蛋白质组学在临床应用中的局限。研究发现,ADAPT-MS通过样本特异性动态重训练策略,无需数据插补即可应对蛋白质组数据中的缺失值问题,同时规避了固定的生物标志物和靶向检测开发的需求;在脓毒症血浆蛋白质组分析中,其能精准实现疾病与健康人群的区分及脓毒症亚型细分,性能优于传统固定特征机器学习模型;在阿尔茨海默病多中心脑脊液蛋白质组研究中,该框架无需复杂数据预处理即可适配不同中心的技术与生物变异,展现出良好的跨中心诊断适配能力,联合多中心数据训练后诊断效能进一步提升。
此外,ADAPT-MS依托简单透明的统计模型保障结果可解释性,避免复杂模型过拟合风险,且具备“单一样本支持多诊断任务”的特性,能从同一蛋白质组测量数据中提取多项诊断结论,分析过程高效。这些结果为将发现型蛋白质组学转化为常规临床诊断工具、实现灵活可扩展的个性化医疗决策提供了关键支撑,也为后续解决临床实施中的相关挑战奠定了基础。
百趣生物血液蛋白冠-DIA 1X:以纳米材料表面修饰技术为核心支撑,通过纳米颗粒与血清/血浆样本的特异性共孵育反应,依托分子间特异性亲和力实现低丰度蛋白的高效富集,进而形成蛋白冠结构。该技术整合样本前处理自动化平台,耦合高灵敏度Astral质谱系统,采用数据非依赖采集(DIA)模式,可实现血液样本的深度蛋白质组学全景分析。相较于常规血液蛋白质组学检测方案,该技术的核心优势在于搭载自主研发的专利磁珠 D1(已获国家专利认证)。从磁珠的精密制备到标准化应用流程,均由专业设备与技术团队全程质控,确保磁珠批次间稳定性与均一性。基于此,检测数据呈现出卓越的质量特征:蛋白鉴定数量稳定突破5000+,蛋白稳定检出率达80%以上,同时显著提升功能性指标的检出丰度,为血液蛋白质组学研究提供了高维度、高可靠性的技术解决方案。