
英文标题:Intestinal TM6SF2 protects against metabolic dysfunction-associated steatohepatitis through the gut–liver axis
中文标题:肠道TM6SF2通过肠-肝轴预防代谢功能障碍相关脂肪性肝炎
发表期刊:nature metabolism
影响因子:20.8
客户单位:香港中文大学
百趣提供服务:新一代代谢组学NGM 2 Pro、定量脂质组学、游离脂肪酸靶标代谢组学
研究背景
代谢功能障碍相关脂肪性肝病(metabolic dysfunction-associated steatotic liver disease, MASLD)是全球范围内最常见的慢性肝病,影响着约10亿人,而23%的MASLD患者可能在3年内发展为更严重的亚型——代谢功能障碍相关脂肪性肝炎(metabolic dysfunction-associated steatohepatitis, MASH)。
TM6SF2是一种参与肝脏脂肪代谢调节的蛋白,其基因变异与脂肪性肝病相关,但肠道中高表达的TM6SF2在MASH中的作用尚未明确。此外,之前研究发现肠道菌群可通过破坏肠屏障和增加有害代谢物的产生来驱动MASH的发展。另一研究表明,携带TM6SF2变体的MASLD患者内毒素血症标志物水平升高。然而,肠道TM6SF2如何影响肠道菌群和肠屏障进而导致MASH的机制尚不清楚。
本文通过构建肠道上皮细胞特异性敲除Tm6sf2的小鼠(Tm6sf2ΔIEC),研究了肠道Tm6sf2缺乏对肠道屏障完整性、肠道微生物群和代谢产物的影响。通过Tm6sf2ΔIEC小鼠的粪菌移植实验证明了肠道微生物群在肠道Tm6sf2缺失诱导的MASH中的重要性。此外,还评估了靶向肠道菌群或阻断代谢物受体对MASH的治疗潜力。
研究结果
1、肠道Tm6sf2缺失可诱发小鼠MASH
本研究构建了肠道上皮细胞特异性敲除Tm6sf2的小鼠(Tm6sf2ΔIEC),正常饮食(NC)4个月后与野生型小鼠(Tm6sf2fl)相比,Tm6sf2ΔIEC小鼠肝脏脂质堆积和甘油三酯含量显著升高(图1d);12个月Tm6sf2ΔIEC小鼠进一步发展为更严重的MASH,主要表现为MASH活动评分、肝脏脂质堆积和甘油三酯含量均显著升高(图1e)。
机制上,Tm6sf2ΔIEC小鼠肝脏中TNF水平上调,同时NF-κB通路激活增强(图1f)。TNF主要由巨噬细胞分泌,流式细胞分析显示,其肝脏中活化巨噬细胞和M1型促炎巨噬细胞的比例均显著增加(图1g)。肝脏转录组测序进一步证实,细胞因子介导的信号通路、脂质代谢过程及NF-κB信号通路等多个MASH相关通路被激活(图1h)。
此外,雌性Tm6sf2ΔIEC小鼠同样出现肝脏脂质堆积、MASH活动评分、甘油三酯含量及血清ALT水平的显著升高,与雄性小鼠结果一致(图1i)。
在胆碱缺乏高脂饮食(CD-HFD)或高脂肪高胆固醇饮食(HFHC)诱导下,Tm6sf2ΔIEC小鼠肝脏脂质积累、炎症(如TNF和IL-6水平升高)及纤维化(胶原蛋白沉积增加)均显著高于野生型小鼠(图1j-l)。
综上,这些发现表明,肠道特异性Tm6sf2缺失可自发触发MASH,并伴随肝脏炎症增强,且该效应在雌雄小鼠中均存在。
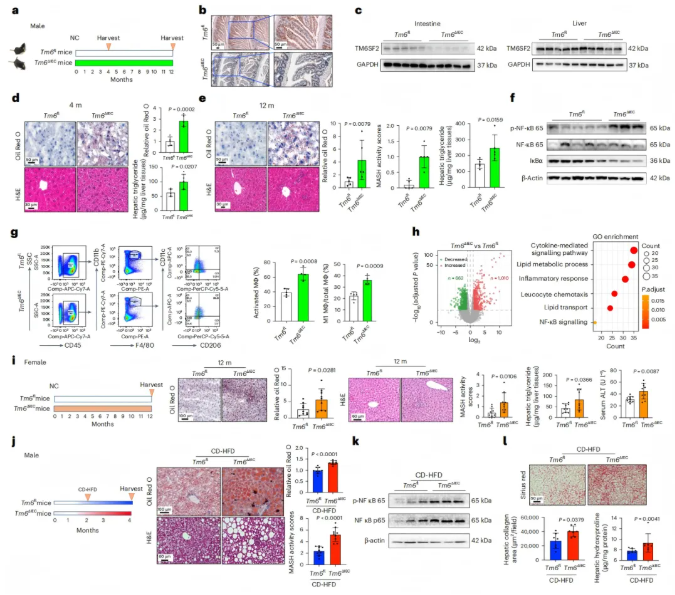
图1. 肠道Tm6sf2缺失可诱发小鼠MASH
2、肠道Tm6sf2缺失导致肠屏障功能障碍和肠道菌群失调
人类肠道和肝脏通过肠-肝轴进行交流,而肠道屏障受损是MASH发育的先决条件。因此,研究团队推测肠道Tm6sf2缺乏可能会影响肠道屏障。研究表明与Tm6sf2fl野生型相比, 无论喂食正常饮食(NC)还是胆碱缺乏高脂饮食(CD-HFD),Tm6sf2ΔIEC小鼠的门静脉血清和肝脏中脂多糖(LPS)水平均显著升高(图2a-b);在CD-HFD喂养下,Tm6sf2ΔIEC小鼠门静脉血清中LPS结合蛋白(LBP)水平也上调(图2c),提示肠道屏障可能受损导致LPS易位。
透射电镜显示,Tm6sf2ΔIEC小鼠肠道细胞间连接存在异常,表现为顶端连接复合体增宽、细胞旁间隙扩大(图2d),肠道物理屏障结构破坏。小肠中粘附蛋白E-cadherin、 紧密连接蛋白Claudin 3和Occludin等肠屏障蛋白均显著下调(图2e-f),表明其肠屏障完整性受损。且体外实验验证在人结肠上皮细胞系Caco2中敲除Tm6sf2后,细胞单层的通透性增加。这些研究结果表明,肠道Tm6sf2缺陷诱导肠屏障功能障碍。
宏基因组测序分析发现,Tm6sf2ΔIEC小鼠与野生型小鼠的菌群结构存在显著差异(图2g),还鉴定了差异细菌分类群,包括潜在的致病菌如卟啉单胞菌科细菌UBA7221、毛螺菌科细菌UBA7098等,而保护性细菌如瘤胃球菌科细菌UBA3323等减少(图2h)。
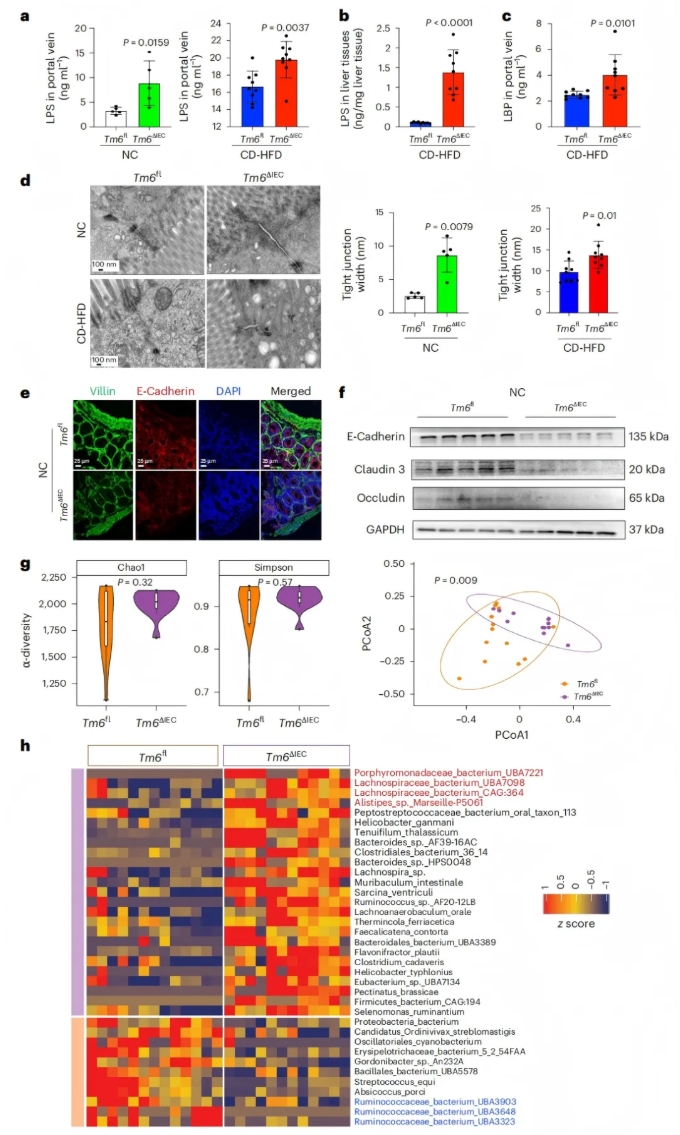
图2. 肠道Tm6sf2缺乏导致肠屏障功能障碍和肠道菌群失调
3、肠道Tm6sf2缺失通过代谢物变化促进MASH
肝脏暴露于门静脉中的代谢物,这些代谢物来源于肠道微生物。因此研究团队通过代谢组学分析,探究肠道Tm6sf2缺失对肠-肝轴代谢物的影响。
非靶标代谢组学分析:为评估肠道Tm6sf2缺失对代谢物的影响,研究对Tm6sf2ΔIEC小鼠和Tm6sf2fl野生型小鼠的粪便、门静脉血清及肝脏组织进行了非靶标代谢组学分析。结果显示,Tm6sf2ΔIEC小鼠与野生型小鼠的粪便、门静脉血清和肝脏组织中的代谢组存在显著差异(图3a),其中溶血磷脂酸(LPA)在 Tm6sf2ΔIEC小鼠的粪便、门静脉血清和肝脏中均持续上调(图3b)。
靶标代谢组学验证:研究通过靶标代谢组学在不同饮食条件下进行验证,无论NC、CD-HFD或HFHC饮食喂养,Tm6sf2ΔIEC小鼠的门静脉血清中LPA水平均显著高于野生型小鼠(图3c)。肝脏组织中,NC或HFHC喂养的Tm6sf2ΔIEC小鼠LPA水平也显著升高(图3d)。
差异微生物和代谢产物之间的相关性分析表明,粪便、门静脉血清和肝脏组织中的LPA水平与富集的细菌(如毛螺菌科、卟啉单胞菌科和Alistipes)呈正相关,而与瘤胃球菌科呈负相关(图3e)。对微生物功能途径的预测分析表明,上述富集的细菌编码酶基因gpsA和plsY参与LPA的合成和转化,结果暗示了这些富集的细菌在肠Tm6sf2缺乏的情况下产生LPA的潜力。
为证实菌群对LPA的调控作用,对无菌野生型小鼠灌胃补充富集的细菌:与对照组相比,细菌处理的小鼠粪便、门静脉血清和肝脏中LPA水平均显著升高(图 3f),因此表明LPA升高至少部分来源于富集的细菌。
体外实验表明:用LPA处理小鼠正常肝细胞(AML-12)和人类正常肝细胞(THLE-2),可显著诱导细胞内甘油三酯积累、脂质过氧化及炎症(图3g-h)。LPA 的作用通过其受体(LPAR)实现,使用LPAR拮抗剂AM095预处理细胞后,LPA诱导的脂质积累、氧化应激和炎症均被显著逆转(图3g-h)。
综上,肠道Tm6sf2缺乏改变了肠道微生物群并增加了LPA的产生,而后者可以通过门静脉循环进入肝脏,促进MASH的发展。
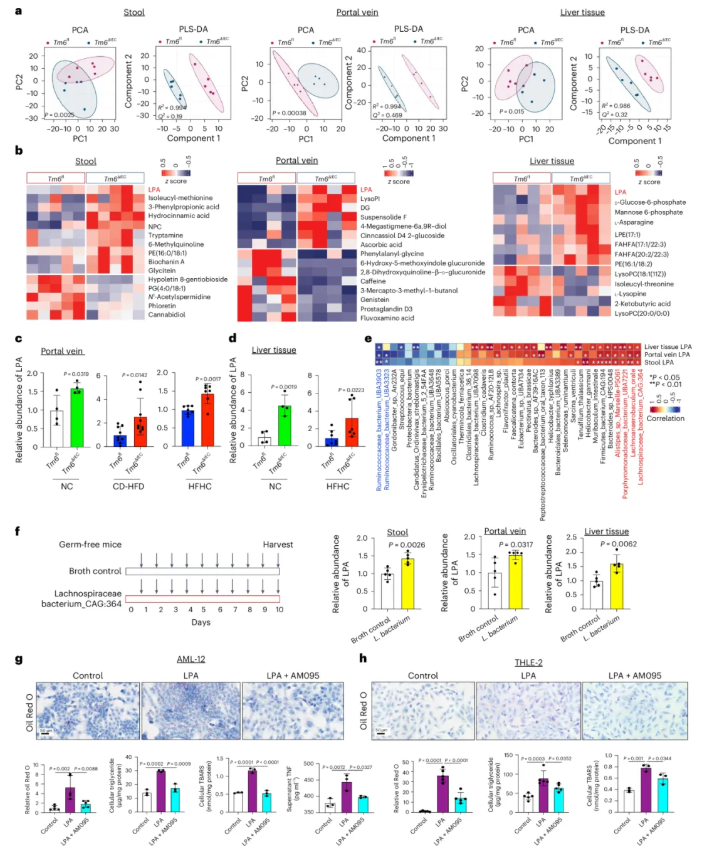
图3. 肠道Tm6sf2缺乏通过诱导代谢物改变促进MASH
4、肠道细胞Tm6sf2缺失通过分泌游离脂肪酸诱导菌群失调
从Tm6sf2ΔIEC和Tm6sf2fl小鼠的小肠分离原代 IEC,并对培养上清液进行非靶标和靶标代谢组学分析(图4a)。结果表明,游离脂肪酸是主要的差异代谢物,其中长链脂肪酸(LCFAs)如花生酸、花生四烯酸等显著上调(图4b-c)。
机制研究发现,肠道Tm6sf2可与脂肪酸结合蛋白5(FABP5)结合(图4e-h),敲除Tm6sf2后LCFAs分泌增加,而过表达FABP5可逆转这一现象(图4i),证实Tm6sf2通过与FABP5结合抑制LCFAs分泌。
补充花生酸或花生四烯酸后,肠道通透性显著增加(图4j),且人结肠上皮细胞(Caco2)单层通透性也升高(图4k),表明这两种LCFAs可直接破坏屏障完整性,并诱导肠道菌群失调,使产生LPA的毛螺菌科富集(图4l)。而与对照相比,门静脉血清中的LPA水平仅在用花生酸处理的小鼠中显著更高(图4m)。
因此,这些发现意味着Tm6sf2缺陷的IEC会导致游离脂肪酸(特别是花生酸)的分泌增加,进而引发肠屏障受损和肠道菌群失调(表现为毛螺菌科富集),二者共同促进LPA的生物合成,最终加速MASH的发育。
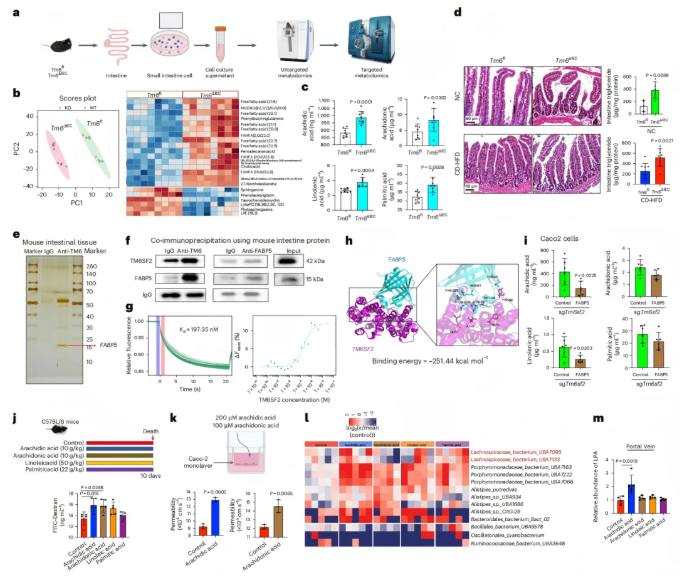
图4. 肠道细胞Tm6sf2缺失通过分泌游离脂肪酸诱导菌群失调
5、肠道菌群在Tm6sf2缺失诱导的MASH中起关键作用
粪菌移植实验表明,移植后4个月,接受Tm6sf2ΔIEC小鼠粪便的无菌小鼠(G-Tm6sf2ΔIEC)出现了肝脏脂肪堆积增加、MASH活动评分升高、肝脏甘油三酯含量和脂质过氧化水平升高,以及肝脏中促炎细胞因子CCL1、CCL12表达上调等现象(图5a-d)。8个月时,G-Tm6sf2ΔIEC小鼠仍表现出肝脏脂质积累和高MASH活动评分(图5e)。表明Tm6sf2ΔIEC小鼠的菌群可直接诱导无菌小鼠出现MASH样表型,证实菌群失调是肠道Tm6sf2缺失诱发MASH的关键介导者。
移植后无菌小鼠的肠道菌群结构与供体小鼠相似,微生物α多样性没有差异,G-Tm6sf2ΔIEC组与G-Tm6sf2fl组的菌群β多样性差异显著,且前者富集供体中存在的致病菌(如L. bacterium CAG:364等),保护性菌减少(图6a-c)。此外,通过非靶标和靶标代谢组学分析发现,与G-Tm6sf2fl小鼠相比,G-Tm6sf2ΔIEC小鼠粪便和门静脉血清中的LPA水平显著升高(图6d-f)。相关性分析进一步表明,致病菌的丰度与LPA水平呈正相关,而保护性菌的丰度与LPA水平呈负相关(图6g)。
综上,肠道微生物群在介导由肠道Tm6sf2缺乏诱导的MASH发育中的重要性。
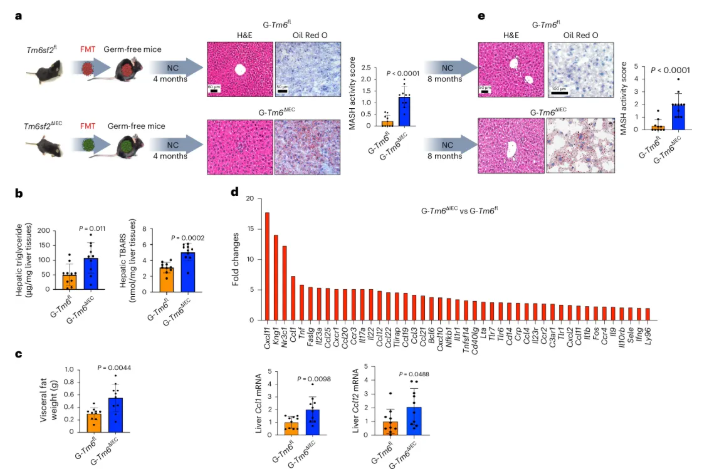
图5. 来自Tm6sf2ΔIEC小鼠的肠道菌群经粪菌移植后可促进NASH的发生
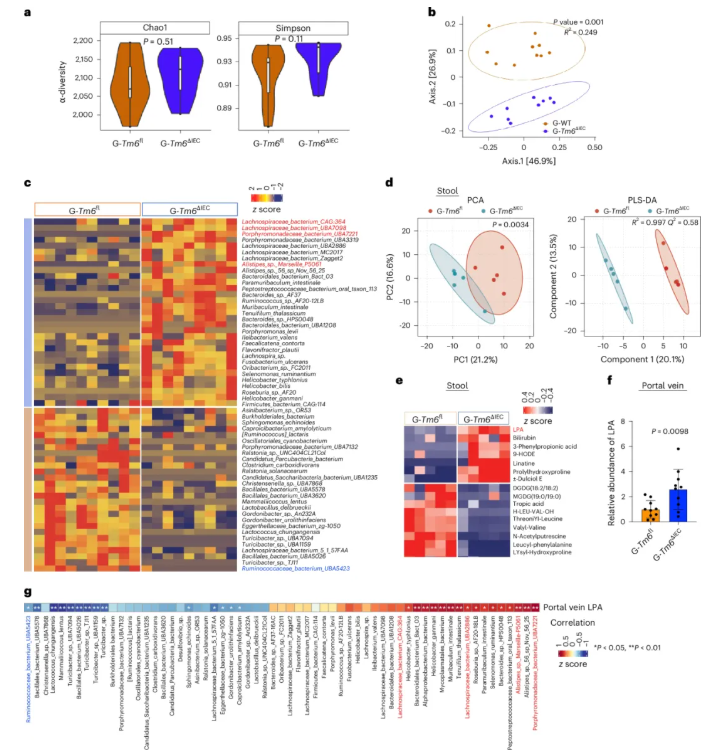
图6. 移植Tm6sf2ΔIEC小鼠粪便的无菌小鼠肠道微生物和代谢组学
6、调节肠道菌群或抑制LPA受体可改善MASH
为研究菌群调节对MASH的治疗潜力,将Tm6sf2ΔIEC小鼠与Tm6sf2fl野生型小鼠共饲养4个月(图7a)。共饲养的Tm6sf2ΔIEC小鼠肝脏脂质积累减少,MASH活动评分降低,促炎因子TNF和IL-6水平下降(图7b-c);肝脏中活化巨噬细胞及M1型促炎巨噬细胞比例显著降低(图7d),炎症反应减弱。
用LPAR拮抗剂AM095处理Tm6sf2ΔIEC小鼠6周(图8a),可显著减少其肝脏脂肪堆积、降低MASH活动评分、肝脏甘油三酯含量和脂质过氧化水平(图8b-c)。
在蛋氨酸胆碱缺乏(MCD)饮食诱导MASH的野生型小鼠模型中,LPAR拮抗剂AM095可减轻饮食诱导的肝脏脂肪堆积、降低MASH活动评分、肝脏甘油三酯含量及血清ALT水平(图8d-f);另一LPAR拮抗剂Brp-LPA也可显著逆转饮食诱导的MASH,减少肝脏脂肪堆积、降低MASH活动评分和肝脏甘油三酯含量(图8g-i)。
综上,调节肠道菌群和抑制LPA受体均可改善MASH,为临床治疗提供了新方向。
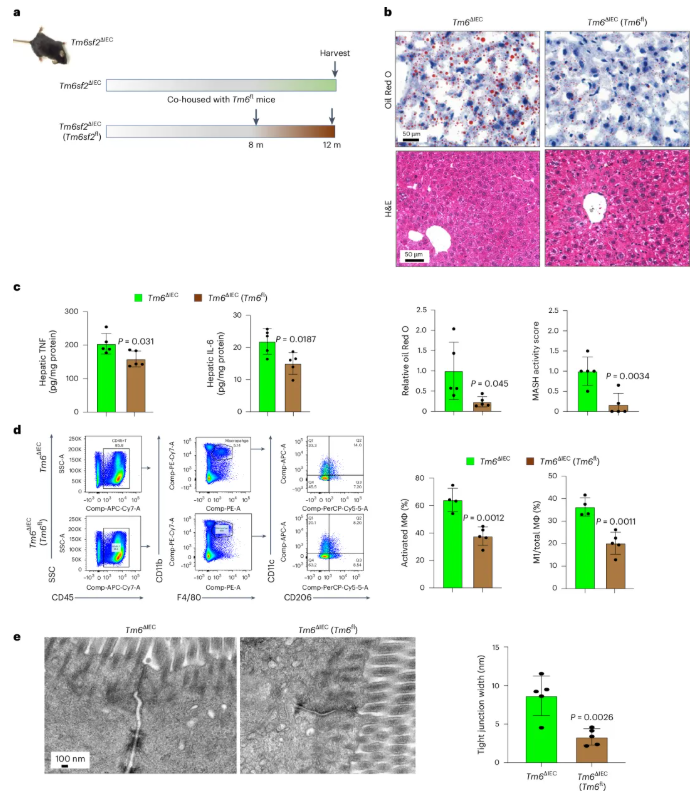
图7. 肠道菌群调节改善肠道Tm6sf2缺乏诱导的MASH
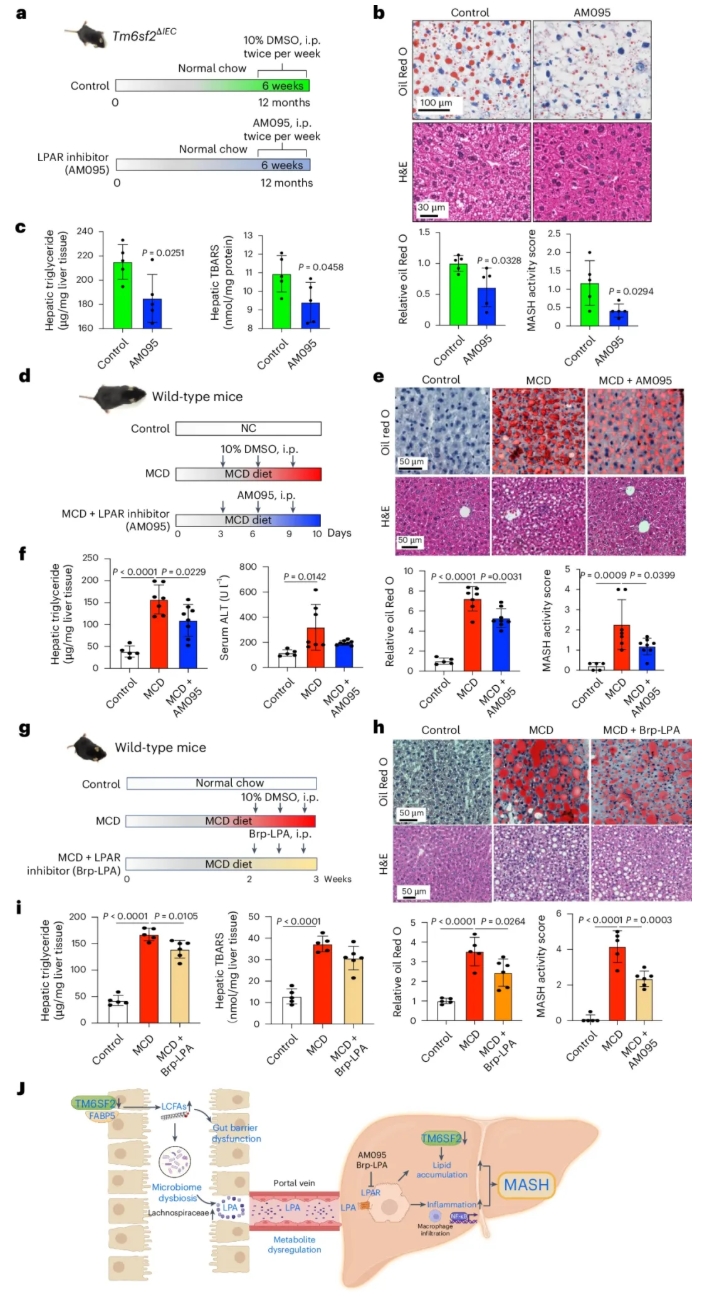
图8. LPA受体的药理学抑制可抑制MASH
研究结论
本研究揭示了肠道Tm6sf2缺失会促进MASH的发展。肠道Tm6sf2与FABP5结合可调节游离脂肪酸的分泌,Tm6sf2缺失导致游离脂肪酸分泌增加,导致肠屏障功能障碍,引起肠道菌群失调和溶血磷脂酸(LPA)水平升高,LPA通过门静脉进入肝脏,导致肝脏脂质积累和炎症反应,最终诱发MASH。此外,研究还证实调节肠道菌群或阻断LPA受体可有效改善MASH,这为Tm6sf2缺失诱导的MASH的预防和治疗提供了潜在的策略。
百趣生物新一代代谢组学NGM 2 Pro:凭借全球领先的2w+代谢物标准品自建库,显著改善代谢组学鉴定准确性不足、数量有限的痛点。其基于LC-MS技术,可检测生物受刺激后小分子代谢物动态变化,助力筛选差异代谢物并关联生理病理。针对代谢物多样性及提取局限,该技术通过多色谱柱联用覆盖非极性/极性代谢物与脂质,结合标准品自建库进一步提升鉴定效率,为标志物筛选、机制研究提供有力支撑。
百趣生物定量脂质组学:是一款专注于脂质精准定量的靶标代谢组学产品,旨在为医学、农林、中医药、食品等领域的科研及产业需求提供高覆盖、高精准的脂质分析解决方案。作为公司主打产品,其通过自建超大脂质数据库、同位素内标一对一校正、双色谱柱(C18+HILIC)采集体系及三维严格质控,实现 “多、准、稳” 的检测优势,助力生物标志物发现、病理机制研究、作物品质改良等多场景应用。
百趣生物游离脂肪酸高通量靶标定量检测:采用同位素内标法定量,显著提升定性、定量的准确性。该服务可精准分析生物样本中的FFA,深入探索其与心血管疾病、糖尿病、肿瘤等发生发展的关联,致力于发现与验证疾病生物标志物、阐明代谢通路机制,为科研与诊断提供强大工具。