
文章标题:Multi-omicsanalysisofapig-to-humandecedentkidneyxenotransplant
发表期刊:nature
影响因子:48.5
研究背景
在当今全球医疗体系中,器官移植等待名单的严重失衡已成为亟待解决的公共健康难题。以美国为例,目前有超过10万名患者等待器官移植,但因供体器官短缺,仅约四分之一的患者最终能获得异体移植器官。在此背景下,跨物种器官移植(异种移植)被视为缓解器官短缺、挽救生命的潜在突破方向。由于器官生理结构和尺寸的相似性,家猪(Susscrofadomesticus)被公认为最适配的异种移植供体物种。通过基因编辑技术(如GGTA1基因敲除),科学家已显著降低了猪器官与人类之间的分子不相容性,从而克服了以α-半乳糖(α-Gal)抗原为主的超急性排斥反应这一关键免疫屏障。美国FDA批准了基因编辑猪GalSafe™GT-KO用于潜在治疗性应用,为异种移植的临床探索提供了合法化基础。
尽管基因编辑猪器官已在非人灵长类动物(non-humanprimates, NHPs)中成功移植,且部分个体存活超过一年,但适应性免疫反应(如抗体介导和细胞介导的排斥)的动态机制仍存在重要研究空白。为填补这一缺口,研究团队创新性地采用脑死亡机械通气人类个体模型,这一模型既能模拟真实移植场景,又能通过长期纵向采集血液和组织样本,最大限度规避伦理与安全风险。此前,相关研究仅限于移植后2-3天的短期观察,而本研究通过整合空间转录组学、单细胞/单核RNA测序、免疫组库测序及深度蛋白质组学技术,首次系统解析了61天跨度内猪异种胸腺-肾脏联合移植在脑死亡人类中的免疫与组织响应演变过程,揭示了两种排斥反应(AbMR与TCMR)的分子标志物及其成功干预的证据,为异种移植的临床转化提供了关键数据支持。
研究结果
通过高分辨率多组学技术(空间转录组、scRNA-seq、蛋白质组学等)动态解析了首例实现61天长期追踪的猪到人Gal-KO胸腺肾异种移植的免疫反应全景,如图1所示。
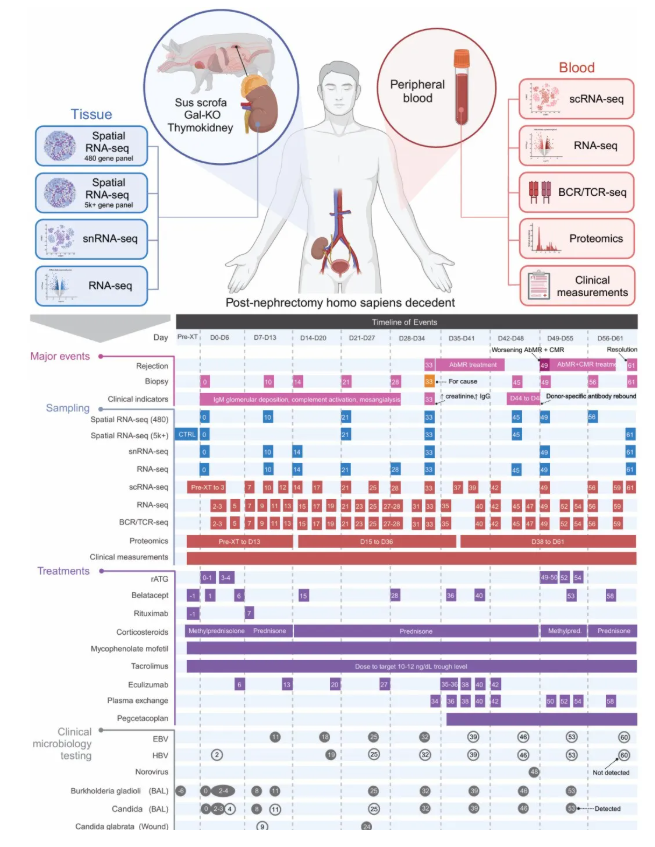
图1.研究概述
在排斥反应动态与治疗响应方面,术后第33天(POD33),移植后出现典型的抗体介导排斥反应(Antibody-mediatedrejection, AbMR),伴随肌酐升高、IgG/C5b9沉积;POD44-48,针对AbMR的治疗(PLEX/皮质类固醇/C3抑制)后出现供体特异性抗体反弹;POD49,新增T细胞介导排斥反应(Tcell-mediatedrejection, TCMR);最终,POD61,经联合免疫抑制治疗,AbMR与TCMR均得到缓解。
借助空间转录组(SpatialTranscriptomics, ST)技术整合组织病理结构与物种特异性转录组(图2),猪肾细胞及浸润的人类免疫细胞被精准定位。结果显示,人类免疫细胞(主要是巨噬细胞、NK细胞、pDCs)从POD21开始浸润移植物,于AbMR高峰期(POD33)占比超20%,治疗后降至3-7%(图3A);NK细胞在血液(POD10/21~30%,POD33-37~40%)和组织(POD21起)中均显著激活与浸润,且血液NK细胞动态经流式细胞术验证(图3D-E);B细胞/浆母细胞在血液中早期(POD7前)和中期(POD17-25)出现峰值,而组织内B细胞浸润峰值滞后(POD45)(图3B-C)。
此外,树突状细胞(cDC1/2)在血液(POD17-33)和组织(cDC2于POD33)中出现动态波动;pDCs在血液中早期增殖,其激活标志物(IRF7、TLR9)及CXCL9-11在组织中表达更高(血液中CXCL9-11表达缺失)。
这些数据表明,血液中先出现先天的NK和B细胞的激活反应,随后这些细胞浸润异种移植物,在活检确认的AbMR(POD33)事件时达到峰值,并在成功治疗后下降。

图2.高分辨率空间转录组分析揭示人类细胞在猪肾脏移植物中的浸润现象
02.BCR测序揭示异种移植中B细胞克隆动态、记忆B细胞再激活与排斥关联机制
为阐明B细胞与浆细胞在排斥反应中的核心作用,B细胞受体测序(BCR-seq)技术被进一步应用(图3G-H)。结果显示,BCR克隆多样性在POD2、19、25、40出现峰值,与先天免疫细胞的应答浪潮同步(图3G),并且存在明确的抗体亚型克隆占比动态变化:早期(POD2-28)以高亲和力的IgA/G克隆为主导,而在AbMR发生及后续阶段(POD31起),IgM/D克隆占比逐渐升高(图3H),揭示了异种移植后B细胞应答的阶段性特征。
值得注意的是,不同亚型BCR克隆的体细胞高频突变率存在显著差异:IgG克隆突变率最高(7.9%),IgA克隆次之(6.4%),而IgM(3.9%)和IgD(3.5%)克隆突变率较低。高突变率的IgA/G克隆提示移植后预存记忆B细胞被快速重新激活,而非初始B细胞的从头应答;而低突变率的IgM/D克隆可能包含部分初始B细胞的活化,共同构成了异种移植后的B细胞应答网络。
结合克隆追踪分析显示,在AbMR确诊(POD33)前的POD17-25期间,存在广泛的多克隆B细胞扩增,这与浆母细胞在该阶段的二次上升(图3B)相呼应,为AbMR发生时的抗体大量产生提供了关键细胞来源。
综上,BCR-seq数据揭示了异种移植后一场以预存记忆B细胞快速再激活为主、伴随部分初始B细胞活化的抗体应答,其呈现明确的克隆多样性动态和亚型占比变化规律,并与先天免疫应答协同,共同参与了AbMR的发生过程。

图3.早期宿主免疫细胞反应,包括巨噬细胞、NK细胞、pDCs和血浆/B细胞
03.巨噬细胞从主要浸润群体到炎症驱动者的演变
联合ST、单细胞核RNA测序(snRNA-seq)等多组学技术,异种移植物内巨噬细胞群体的动态变化与功能特化被深入解析。显而易见,巨噬细胞乃是移植物内最主要的人类免疫细胞(图2G-I, 3I)。结合关键亚群动态,在AbMR高峰期(POD33),一个独特的CXCL9⁺巨噬细胞亚群显著扩增,其成为该时间点最主要的人类免疫细胞类型(>6%总细胞)(图3I),该亚群高表达CXCL9/10/11、STAT1等关键趋化因子和信号分子,并强烈富集于干扰素应答、中性粒细胞活化及细胞因子信号等促炎通路(图3J)。
此外,一个“干扰素+”细胞群体在POD33达峰,其特征是高表达干扰素刺激基因(如MX1、IFIT1),并富集I型干扰素应答通路(图3J)。该群体表现为巨噬细胞与T细胞的混合体,共享强烈的免疫激活特征,共同放大了炎症环境。
结合不同技术平台,上述巨噬细胞亚群的存在及其在POD33的关键作用均被一致验证。全局分析显示,CXCL9/10/11的表达在POD21-33期间显著上调,并于排斥峰值后随治疗下降,清晰地勾勒出与排斥事件同步的分子轨迹(图3K)。
值得注意的是,CXCL9⁺巨噬细胞形成的趋化因子热点区域可引导NK细胞和T细胞浸润与分化,且与pDCs、T细胞存在空间共定位,是连接先天免疫与适应性免疫的核心枢纽。
综上,在异种移植排斥中,巨噬细胞不仅是主要的浸润细胞,更在排斥关键期分化为功能特化的促炎亚群(如CXCL9⁺),通过释放趋化因子(CXCL9/10/11)、驱动干扰素信号、介导补体激活、血管损伤及细胞间相互作用等多重机制,主动塑造了促炎微环境,从而推动了排斥的进展。
04.克隆性T细胞与跨物种细胞互作主导免疫攻击网络
将多组学技术(scRNA-seq、ST、TCR-seq、流式细胞术、血液蛋白质组学)整合联用,T细胞克隆演化、组织损伤重塑与全身补体激活在异种移植排斥中的动态网络被系统解析(图4、5、6)。
主要内容如下:
在外周血与移植物内,T细胞从POD14开始持续增加,于POD33-45达到浸润峰值,并随追加免疫抑制治疗下降(图4)。结合TCR-seq,发现TRBV2/J1基因优势克隆扩增,鉴定出持续存在的顶级克隆,其与病毒特异性免疫、造血移植后免疫重建相关,且部分为异种供体反应性克隆(图4R-T)。此外,浸润T/NK细胞高表达CD38、TNFRSF9及CD103,提示效应功能与局部定居倾向(图4Q)。
透过空间转录组技术,SPP1+和COLEC11+损伤细胞群于POD21起显著增加,高表达HIF1A、ICAM1等炎症基因(图5A-E)。人类免疫细胞、猪肾损伤细胞与猪驻留巨噬细胞空间共定位,形成互作生态位,驱动局部炎症(图5F-H);猪细胞亦上调MX1、IFIT1等干扰素应答基因,参与排斥微环境构建。
血液蛋白质组学显示,补体凝集素途径(MBL/MASPs)和替代途径(C3a/C3b)于POD20左右达峰,POD34启动补体抑制治疗后下降,人类C3a在治疗后6-7天降至低谷,为AbMR提供液体活检证据(图6)。
综上,预存、病毒特异性或异种反应性T细胞克隆性扩增,与先天免疫细胞协同浸润移植物,通过与猪肾损伤细胞、驻留免疫细胞的空间互作,借助炎症因子、损伤标志物(SPP1、COLEC11)及补体级联反应,共同导致移植物组织重塑与功能损伤。
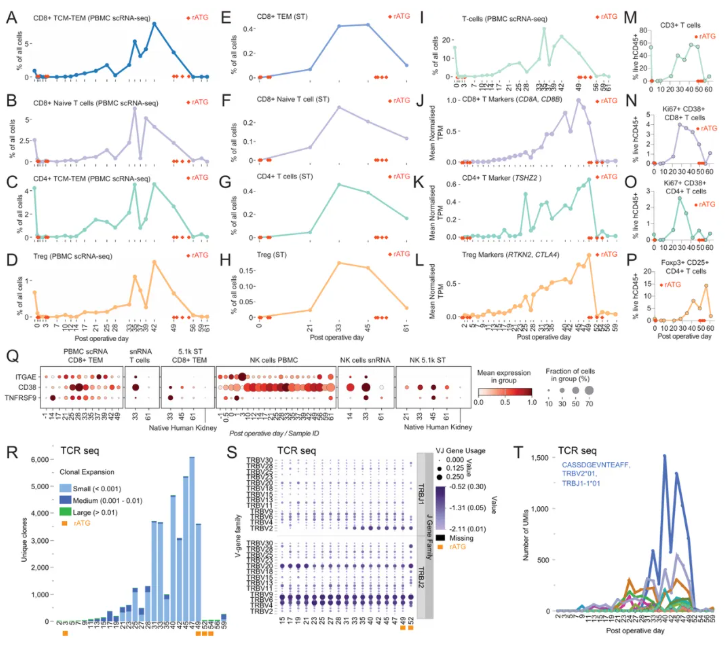
图4.人类T细胞对异种移植的反应
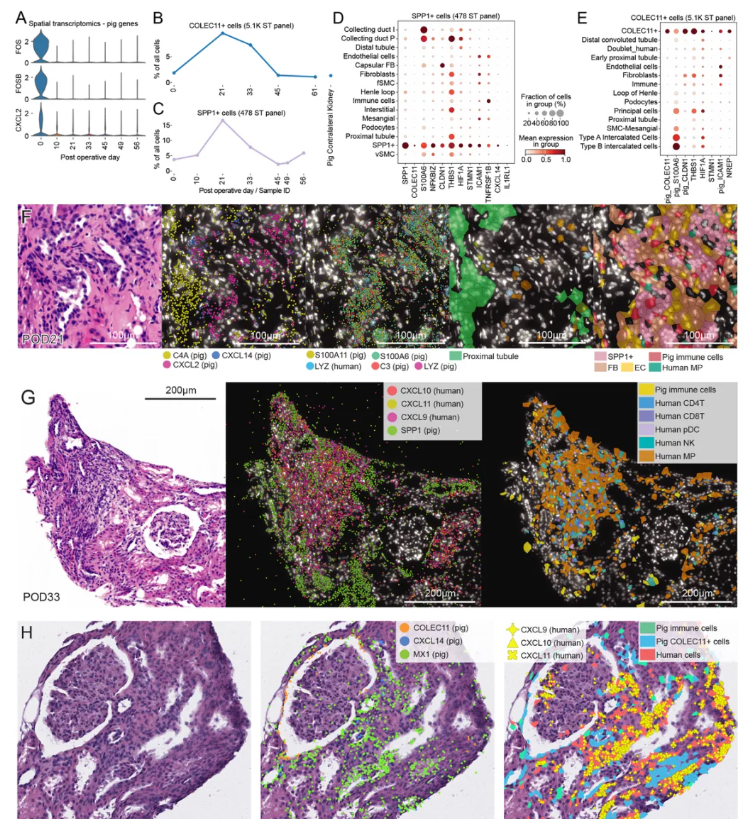
图5.移植猪组织在POD21与POD33出现显著的损伤信号
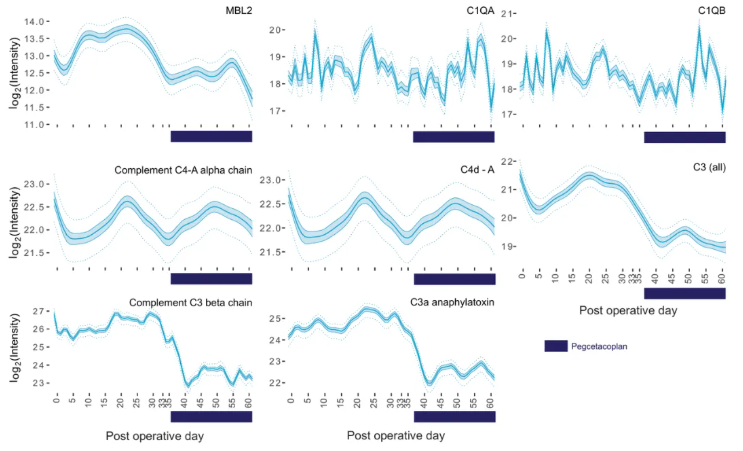
图6.血清中选定补体通路组分的蛋白水平动态变化
研究小结
本研究通过对猪到人肾异种移植模型的61天动态多组学分析(涵盖血液与移植物),系统揭示了导致排斥的协同免疫攻击网络:
先天免疫与抗体应答有序启动:POD0-28已出现IgM沉积及补体激活,后续浆母细胞、NK细胞与树突状细胞在POD10-28进一步扩增,伴随IgG/IgAB细胞克隆扩增,最终触发抗体介导排斥(AbMR,POD33)。
T细胞克隆增殖与混合排斥:T细胞从POD14开始增多,POD21后持续增殖,其受体库多样化及特定TRBV2/J1克隆扩增,与后续的细胞介导排斥(TCMR,POD49)密切相关,形成混合排斥表型。
巨噬细胞主导的炎症微环境:在排斥高峰(POD33),基于5.1k空间转录组数据,CXCL9+巨噬细胞占比超6%总细胞,成为移植物内最主要的人类免疫群体,驱动IFN-γ炎症风暴,并发现猪驻留巨噬细胞与人类浸润免疫细胞在组织局部存在相互作用的直接证据。
进行性组织损伤与补体激活:移植物出现以SPP1+、COLEC11+为标志的纤维化损伤;血液蛋白质组学证实人与猪补体系统均被激活,且补体抑制治疗可有效下调该反应。
综上,这项研究首次在时空维度上完整描绘了异种移植排斥的分子与细胞全景,为开发针对性的免疫调控策略、延长移植物存活提供了关键理论基础与潜在新靶点。
百趣生物血液蛋白冠-DIA 1X:以纳米材料表面修饰技术为核心支撑,通过纳米颗粒与血清 / 血浆样本的特异性共孵育反应,依托分子间特异性亲和力实现低丰度蛋白的高效富集,进而形成蛋白冠结构。该技术整合样本前处理自动化平台,耦合高灵敏度 Astral 质谱系统,采用数据非依赖采集(DIA)模式,可实现血液样本的深度蛋白质组学全景分析。相较于常规血液蛋白质组学检测方案,该技术的核心优势在于搭载自主研发的专利磁珠 D1(已获国家专利认证)。从磁珠的精密制备到标准化应用流程,均由专业设备与技术团队全程质控,确保磁珠批次间稳定性与均一性。基于此,检测数据呈现出卓越的质量特征:蛋白鉴定数量稳定突破 5000+,蛋白稳定检出率达 80% 以上,同时显著提升功能性指标的检出丰度,为血液蛋白质组学研究提供了高维度、高可靠性的技术解决方案。