
英文标题:Monitoring and dynamically controlling glucose uptake rate and centralmetabolism
中文标题:监测并动态控制葡萄糖摄取速率和中枢代谢
发表期刊:nature chemical engineering
百趣提供服务:靶标代谢流
研究背景
近年来,系统代谢工程(Systems metabolic engineering)通过整合代谢工程、系统生物学、合成生物学及进化工程等多学科工具与策略,为构建高效生产药物、化学品、饲料及食品添加剂的微生物细胞工厂开辟了新路径。这一领域进展的核心在于对代谢过程中关键代谢物及合成途径的精准监测与调控。然而,传统方法在代谢物检测的灵敏度、实时性以及对动态代谢通量的响应能力上存在显著局限,难以满足工业级生产的高效需求。
作为天然存在的信号探测器,能够感知环境及细胞内外的代谢物浓度,其遗传编码版本(如基于荧光的基因回路)已成为代谢研究的重要工具。它们不仅可直接检测目标分子或中间代谢物,还能通过动态调节基因表达,优化代谢通量分配,从而提升产物合成效率。但现有生物传感器多局限于胞内中间代谢物的检测,导致调控范围受限,难以实现对整体代谢通量的全局控制。
葡萄糖(Glucose)作为微生物培养中最常用的廉价碳源,其摄取速率直接影响代谢通量分配、产物产量及生产效率。尽管传统生物传感器可监测葡萄糖浓度,却无法直接捕捉摄取速率这一关键动态指标。为解决这一瓶颈,研究者开发了可编程双功能遗传回路GURB,实现了对葡萄糖摄取速率的实时监测,并基于此动态调控细胞代谢网络,成功提升L-色氨酸(L-Trp)、核黄素(Riboflavin)及D-乳酸(D-lactic acid)等产品的微生物合成效率,为系统代谢工程的工业化落地提供了新思路。
研究结果
01-葡萄糖摄取速率生物传感器的设计
DNA结合转录抑制因子Mlc是一种转录双重调节因子,控制着大肠杆菌PTS和PEP系统中几个编码酶的基因的表达。基于Mlc在葡萄糖摄取中的功能,可将大肠杆菌的Mlc调控系统克隆至载体中,用以构建合成型葡萄糖摄取速率生物传感器(Glucose uptake rate biosensors,GURB),实现葡萄糖摄取速率的测量(图1a)。具体而言,当葡萄糖存在时,葡萄糖摄取会伴随EIIB(Enzyme IIB)的去磷酸化,生成葡萄糖-6-磷酸;接着,去磷酸化的EIIB可结合并招募Mlc至细胞膜;最后,Mlc与EIIB的结合促使荧光素酶的luc-C和luc-N结构域重新组装并激活,添加荧光素底物后即可获得可见光输出(图1b)。
基于上述机制,由“PptsG启动子+GFPmut2荧光蛋白+p15AS载体”构建的初始生物传感器GURB1被分别导入至六个具有不同葡萄糖摄取率的菌株中(MGU1-6)(图1c)。结果显示,携带GURB1的细胞的荧光强度与这六个菌株的葡萄糖摄取率呈负相关,表明GURB1反映出摄取速率的变化。此外,除了受Mlc抑制外,ptsG还受全局调控因子Crp的调控。
为探究Crp对PptsG的干扰效应,通过截短PptsG启动子并在截短的PptsG中失活Mlc结合位点来激活荧光蛋白mCherry的表达,构建出3种传感器变体(GURB2、GURB3和GURB4),随后也都同样导入至MGU1-6菌株中。然而,仅有GURB3成功地破坏了Mlc结合位点而不影响启动子活性(图1d)。由此推断,除了Mlc之外,还可能存在另一个激活ptsG表达的因素。值得注意的是,若再进一步截短启动子,直至去除其中一个Crp结合位点时,所得传感器GURB3-2在具有相同葡萄糖摄取率的菌株中的响应则有所减弱(图1e),这为后续更窄范围内控制葡萄糖摄取率奠定了基础。
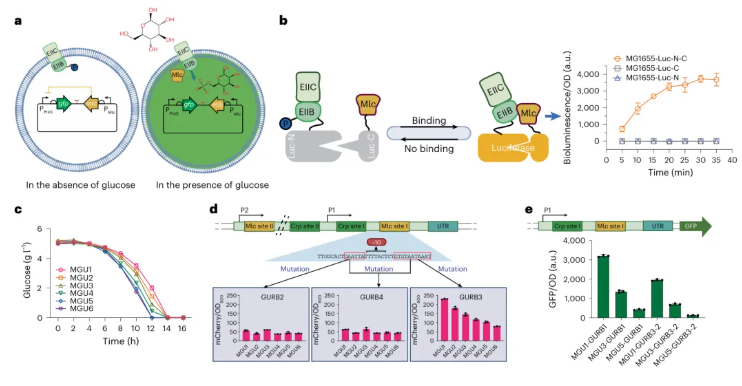
图1 葡萄糖摄取率生物传感器的设计
02-正响应GURB的设计与优化
为构建葡萄糖摄取速率呈正响应的生物传感器,通过Mlc结合位点及人工启动子PAR的切割与组合,三种杂交启动子被构建(图2a)。结果显示,Mlc结合位点在PAR启动子中的位置显著影响其表达强度(图2b),具体表现为:位于+1位点下游的PAD启动子强度比原始PAR高约3.6倍;位于-10与-35区域间的PAM启动子强度降低至PAR的约1.9倍。此外,Mlc还显著抑制了PAD启动子的转录(图2b),表明Mlc可通过结合DNA来阻碍转录。有趣的是,若进一步调整Mlc结合位点与+1位点的距离,则还会影响这些启动子的动态范围,呈现出显著差异(图2c)。由此可见,通过设计Mlc结合位点可以实现正响应GURB的构建。
后续,7种Mlc结合序列(来自ptsG、ptsH、malT、manX、mlc的启动子)及表面等离子共振(SPR)技术被用于进一步优化提升生物传感器动态范围(图2d)。其中,ptsHBS结合亲和力最高(8.7×10-10),manXBS1最低(3.73×10⁻⁷)。另外,在体内测试中,结合亲和力过强(如Mlc-ptsHBS)会导致回路对葡萄糖摄取速率响应降低,以及低摄取速率菌株的生长受损;亲和力最弱的Mlc-manXBS1在低葡萄糖摄取条件下非但不影响菌株生长,反而动态范围最佳(图2e-f)。因此,蛋白质与DNA结合过强并非总有利于生物传感器的设计。
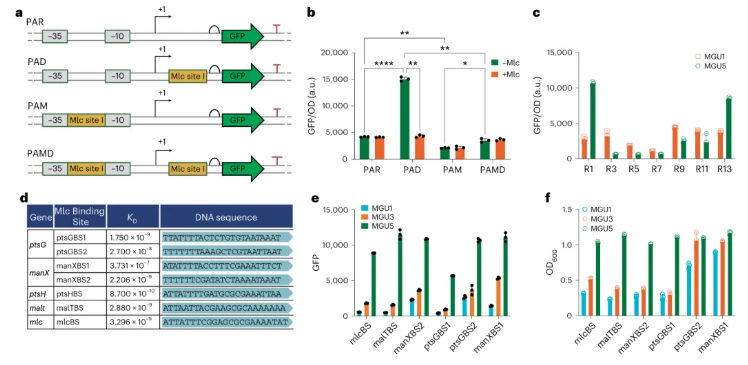
图2 对葡萄糖摄取率有正反应的GURB变异体的构建和鉴定
03-细胞内葡萄糖摄取速率的实时监测
GURB监测葡萄糖摄取速率的工作原理如图3a所示:当葡萄糖摄取速率较低时,生物传感器产生较少的荧光蛋白,便于监测;反之,当葡萄糖摄取速率较高时,则产生更强的荧光。为了验证生物传感器在细菌培养过程中的运行情况,将GURB28导入六种不同摄取速率的菌株进行培养。结果显示,不同菌株间,在线荧光强度增强与离线葡萄糖消耗速率呈显著正相关;同样地,同一菌株的各培养阶段,该正相关性也均持续存在(图3c)。此外,该生物传感器仅对葡萄糖高度敏感(图3d),且不受PTS系统中磷酸供体PEP的影响,亦证实了GURB的正交性。综上,GURB可作为通量传感系统的组成部分,反映出菌株的葡萄糖摄取速率。
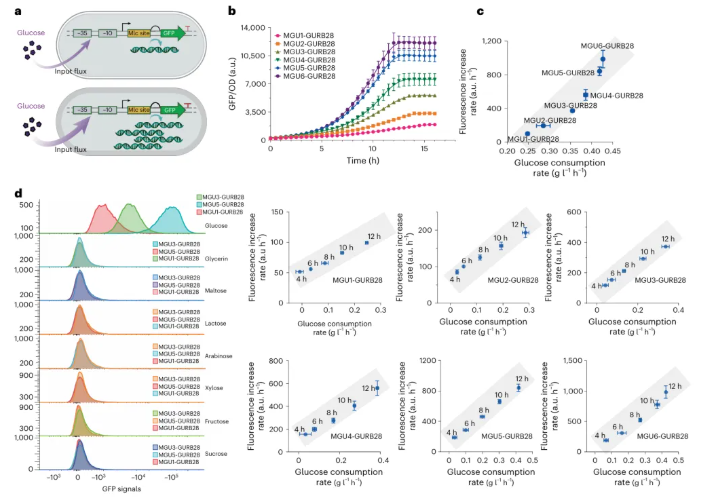
图3 GURB28反应的定量分析
04-通过GURB在不同培养条件下可视化葡萄糖摄取
通过选择不同初始葡萄糖浓度、pH值、盐浓度和温度的培养体系,以探究菌株在不同培养条件下的葡萄糖摄取速率。总体而言,葡萄糖浓度与温度对摄取速率影响相对较小:当初始葡萄糖浓度在1-20g/L范围内时,菌株的摄取速率基本保持稳定,而低于3g/L时,葡萄糖被细胞快速完全消耗(图4a);当温度在30-40℃变化时,摄取速率无显著差异(图4d),但低摄取菌株的生长会在30℃下受到抑制。对于pH和盐浓度而言,其葡萄糖摄取速率则表现出显著变化:在pH7时,菌株摄取速率最高且生长良好,但随着pH降低,其摄取速率严重下降,细胞生长显著抑制(图4b),尤其在低摄取菌株MGU1中更为明显;在盐浓度0.5%时,摄取速率最高,但升至2.5%时,其摄取速率被严重阻断,细胞生长显著受抑(图4c),表明过高或过低的盐浓度均会使葡萄糖摄取速率不同程度下降。以上结果证实,GURB能够准确监测不同培养条件下菌株的葡萄糖同化情况。
此外,在连续培养实验中,当环境条件(pH或盐浓度)发生改变时,GURB传感器的荧光信号也会迅速响应,反映摄取速率的动态变化。例如,pH从7降至4时,荧光强度显著下降,随着环境恢复,其信号也迅速回升;同样地,盐浓度从0.5%升至4%时,信号再次下降,恢复后信号再次恢复(图4e)。若进一步与恒定pH和NaCl培养的对照组对比,可以发现,随着培养条件的改变,细胞的最大葡萄糖摄取速率也相应波动(图4f)。
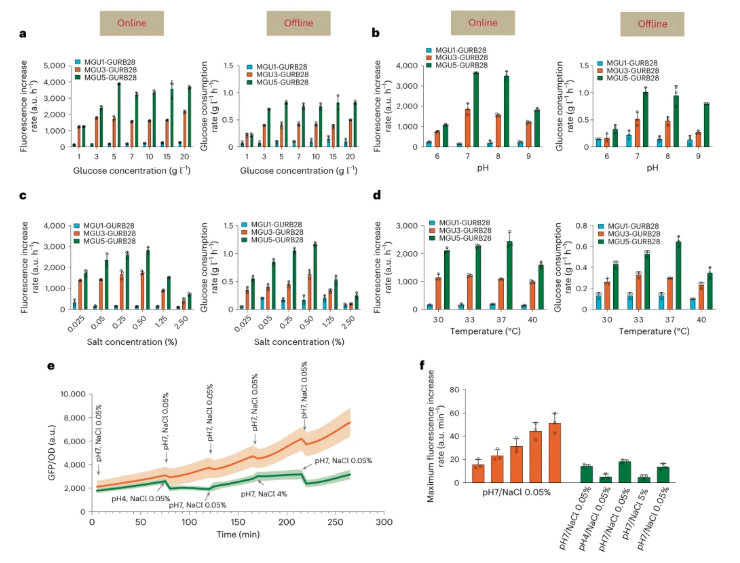
图4 利用在线生物传感器与离线残糖分析仪在不同培养条件下测定的菌株葡萄糖摄取速率
05-GURB对菌株内代谢途径的动态调节
以L-Trp合成为概念验证,用以测试GURB调控产物合成,L-Trp生产菌株T4首先被系统性构建。值得注意的是,磷酸戊糖途径产生的关键前体E-4-P(赤藓糖-4-磷酸)是L-Trp合成的主要限制性底物,尽管直接增强磷酸戊糖途径基因的表达可提升L-Trp产量,但其增幅显然不够显著(图5b)。于是,通过进一步动态调控磷酸戊糖途径通量(增强zwf基因表达、抑制ptsG基因表达),一种依赖葡萄糖摄取速率的反馈回路被构建(图5a)。显而易见,在相同培养条件下,持有该反馈回路的T4DT菌株,其L-Trp产量较对于对照(T4菌株)提升了91%;同时,副产物乙酸的浓度显著下降(图5b),表明其动态调控有效优化了碳通量分配,减少浪费。此外,与静态调控菌株T4JT(基于T4菌株构建)、T4DTC菌株(敲除mlc的T4DT菌株)相比,动态调控菌株T4DT亦显示出绝对优势(图5b)。随后,经RT-qPCR证实,GURB对关键基因具有实时调控能力,即ptsG与zwf基因表达水平会随着葡萄糖摄取速率的变化而被动态抑制或激活(图5c)。
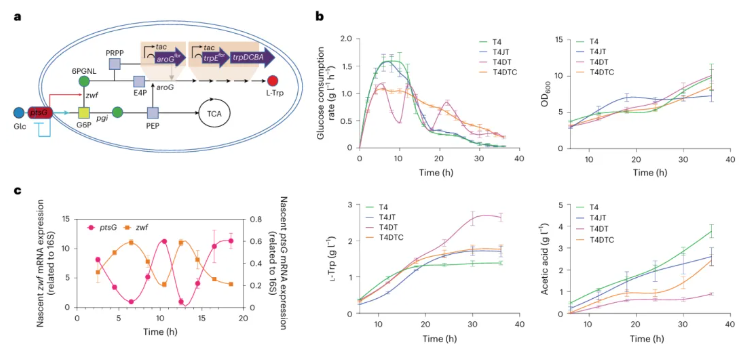
图5 利用GURB系统通过动态调控强化大肠杆菌中L-色氨酸的生物合成
为了进一步验证和应用GURB系统控制生物合成途径,在核黄素生产菌株R1中引入类似的GURB反馈回路,以平衡生长与前体供应(图6b)。结果显示,动态调控(抑制pgi、激活zwf)的菌株R2DT的核黄素产量显著高于静态调控(敲除pgi并过表达zwf)的对照菌株R2JT(提高59.4%),也远高于敲除mlc的对照菌株R2DTC,凸显出GURB反馈回路的动态调控在平衡生长与合成上的优势。
类似地,针对需要强化糖酵解通量的D-乳酸生产,设计出相反的动态回路(激活pgi、抑制zwf)。如预期所料,动态调控菌株Lac04-DT的D-乳酸产量较原始菌株Lac04提高40.6%,并且也显著优于静态调控对照菌株Lac04-JT及敲除mlc的对照菌株Lac04-DTC(图6d)。
综上所述,在L-Trp、核黄素和D-乳酸三种不同产物的生物合成中,基于GURB的动态调控策略均能通过实时感知葡萄糖摄取速率,智能平衡中心代谢流,显著提高目标产物产量并减少副产物,其效果优于传统的静态调控方法,验证了该传感-调控平台的普适性与高效性。

图6 利用GURB系统通过动态调控强化大肠杆菌中核黄素与D-乳酸的生物合成
研究总结
本研究成功开发了一套可编程的双功能葡萄糖摄取速率生物传感器(GURB),实现了对细胞葡萄糖摄取速率的实时监测与动态调控。该工具成功应用于优化中心代谢,通过构建基于GURB的反馈回路,在L-色氨酸、核黄素和D-乳酸的合成中,动态平衡了不同代谢途径的碳流,显著提高了目标产物产量,并有效减少了副产物积累。这项工作突破了传统静态代谢工程的局限,为解决代谢失衡、提升微生物细胞工厂性能提供了强大的通用型合成生物学工具,在菌株筛选、智能发酵控制及复杂代谢网络优化等方面具有广阔的应用前景。
百趣生物靶标代谢流:基于稳定同位素示踪技术,聚焦糖酵解、TCA循环、PPP途径等关键代谢通路,可精准分析代谢物动态流量变化,实现代谢物高覆盖、高精准定量,助力揭示代谢通路活性、验证代谢调控机制,为生命科学研究及临床转化提供可靠数据支撑。