
英文标题:Pharmacological inhibition of PSPH reduces serine levels and epileptic seizures
中文标题:磷酸丝氨酸磷酸酶(PSPH)的药理学抑制可降低丝氨酸水平并减少癫痫发作
发表期刊:nature chemical biology
影响因子:13.7
客户单位:中国医学科学院基础医学研究所
百趣提供服务:600MRM(现升级为AQ700高通量靶标定量)
研究背景
颞叶癫痫(TLE)是最常见的难治性癫痫类型,降低N-甲基-D-天冬氨酸受体(NMDAR)配体水平被认为是治疗TLE的潜在策略。D-丝氨酸可激活海马体中的突触NMDAR,但它对癫痫发作的影响尚不明确。
中国医学科学院基础医学研究所许琪教授团队在nature chemical biology上发表了题为“Pharmacological inhibition of PSPH reduces serine levels and epileptic seizures”的研究文章。研究发现:清除D-丝氨酸或阻断其与NMDAR的结合可抑制小鼠模型的癫痫发作。星形胶质细胞来源的 L-丝氨酸通过磷酸丝氨酸磷酸酶(PSPH)调控胞外D-丝氨酸水平和癫痫发作活性,据此研究人员鉴定出一种强PSPH抑制剂Z218484536,该抑制剂可减少TLE小鼠模型和TLE食蟹猴模型的自发性癫痫放电。
这些结果表明PSPH是治疗TLE的潜在治疗靶点,支持Z218484536进一步的临床前研究。
研究结果
01 D-丝氨酸对海人酸(KA)诱导的急性癫痫发作至关重要
已知D-丝氨酸是海马体突触NMDAR的主要共激动剂,但它在TLE中的具体作用尚未明确。
为厘清这一问题,研究人员首先分析了临床样本:对比非TLE 捐赠者、无海马硬化(HS)的TLE患者及有HS的TLE患者的海马组织,发现有HS的TLE样本中,谷氨酸和丝氨酸水平显著高于正常样本和无HS的TLE样本,而甘氨酸水平在各组间无差异(图1a-c)。
随后,研究人员建立KA诱导的TLE小鼠模型,单侧海马注射KA 4周后,小鼠海马体中的L-丝氨酸和D-丝氨酸水平均较对照组明显升高(图1d-g)。
为明确D-丝氨酸对癫痫发作的直接影响,研究人员另向清醒小鼠单侧海马注射7ng KA,成功诱导出多次非惊厥性癫痫发作(少数小鼠出现惊厥性发作,图1h);在此基础上进行干预实验:
1.补充低剂量D-丝氨酸后,癫痫发作潜伏期显著缩短,发作次数和持续时长明显增加(图1i-k);
2.注射D-氨基酸氧化酶(DAAO)降解体内D-丝氨酸,可几乎完全抑制KA诱导的急性癫痫发作,而热灭活的DAAO(hiDAAO)无此效果(图1i-m);
3.使用NMDAR甘氨酸调节位点拮抗剂7-氯犬尿氨酸(7-CKA)阻断D-丝氨酸与NMDAR的结合,同样能抑制癫痫发作,且甘氨酸本身无促癫痫作用(排除了7-CKA通过竞争甘氨酸发挥作用的可能);
4.特殊情况下,补充高剂量D-丝氨酸反而会抑制癫痫发作(图1i-m),这一现象与高剂量D-丝氨酸竞争性结合NMDAR的谷氨酸结合位点有关,属于人为药理干预效应,并非TLE病理状态下的主要机制。
综上,D-丝氨酸对KA诱导的急性癫痫发作至关重要:TLE病理状态下,D-丝氨酸水平异常升高会促进癫痫发作;而通过降解D-丝氨酸(如DAAO)或阻断其与NMDAR的甘氨酸调节位点结合,可有效发挥抗癫痫效应。
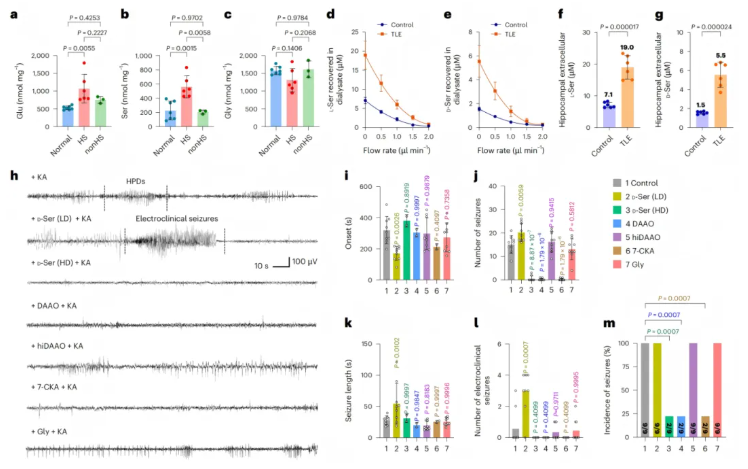
图1.D-丝氨酸促进KA诱导的急性癫痫发作
02 D-丝氨酸耗竭抑制慢性癫痫发作
为深入研究D-丝氨酸对TLE慢性病程的调控作用,研究人员对KA诱导的慢性TLE小鼠模型植入硬膜下螺钉电极和海马注射套管(扩展数据图1a),连续记录20小时脑电图以获取基线海马阵发性放电(HPDs)后,分别注射相关试剂进行干预。
结果显示:
1.与溶媒组(Vehicle组)相比,注射DAAO降解D-丝氨酸可在后续12小时显著抑制HPDs(扩展数据图1b-g);
2.NMDAR甘氨酸调节位点拮抗剂7-CKA同样能显著抑制HPDs(扩展数据图1h-j);
3.额外注射D-丝氨酸未增加HPDs频率(扩展数据图1k-m),推测可能因TLE小鼠的NMDAR已被内源性升高的D-丝氨酸饱和;
4.注射甘氨酸对HPDs无明显影响(扩展数据图1n-p),进一步证实TLE慢性发作中D-丝氨酸而非甘氨酸是调控NMDAR活性的关键共激动剂。
5.综上,升高的D-丝氨酸可促进TLE慢性癫痫发作,耗竭D-丝氨酸或阻断其与NMDAR的结合具有强效抗慢性癫痫作用,且该效应具有特异性。
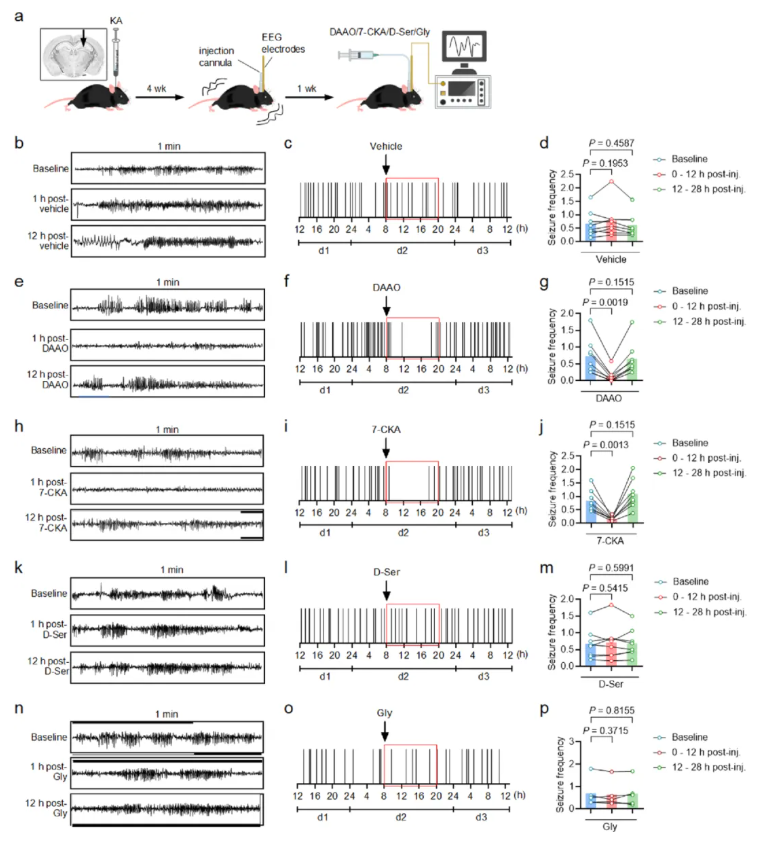
扩展数据图1.D-丝氨酸调控自发性复发性癫痫发作
03 D-丝氨酸耗竭减弱CA2神经元癫痫样放电
严重HS患者的海马体中,CA2亚区和齿状回(DG)的神经元丢失程度显著低于其他区域,因此CA2亚区、DG及下托被推测是癫痫发作起始和扩散的关键区域。
为明确D-丝氨酸耗竭产生抗癫痫效应的神经生理学机制,研究人员开展了针对性的电生理实验。
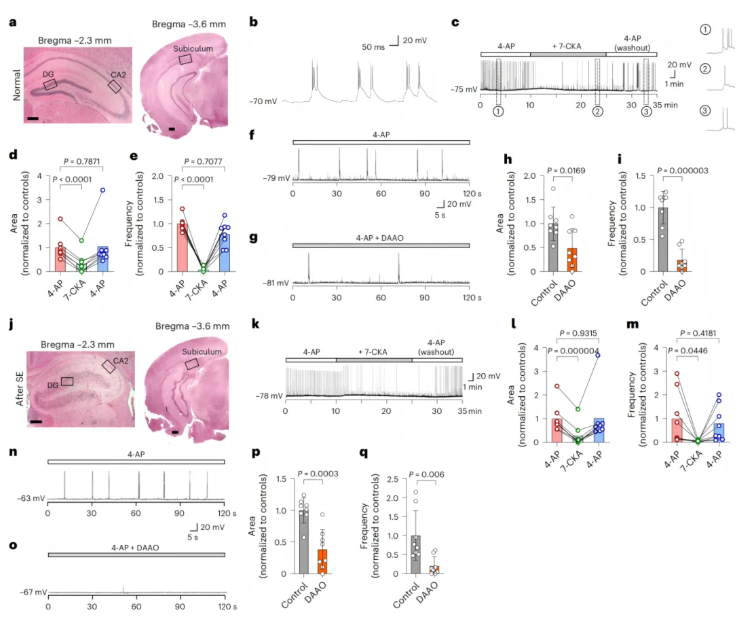
首先对正常小鼠的海马脑切片进行处理,通过膜片钳技术记录DG、CA2和下托神经元的电活动(图2a);同时利用Cre依赖型腺相关病毒(AAV2-hSyn-DIO-GFP)在Amigo2-Cre小鼠的海马体中特异性标记CA2神经元(补充图2),为精准记录CA2神经元电信号提供基础。
实验中,使用特异性阻断电压门控钾通道的4-氨基吡啶(4-AP)处理脑切片,成功诱导出癫痫标志性的细胞级表现——阵发性去极化漂移(PDS),其特征为神经元短暂去极化并引发一连串动作电位(图2b)。
在此基础上进行干预实验,结果如下:
1.向脑切片浴槽中灌流NMDAR甘氨酸调节位点拮抗剂7-CKA,可显著抑制CA2神经元的4-AP诱导PDS,洗去7-CKA后抑制效应消退(图2c-e);
2.灌流DAAO降解D-丝氨酸,同样能强烈抑制CA2神经元的PDS(图2f-i);
3.对比其他脑区神经元:7-CKA和DAAO对DG神经元的PDS仅表现出有限抑制作用(扩展数据图2a-d),对下托神经元的PDS则无明显抑制效应(扩展数据图2e-h);
4.在KA诱导的慢性TLE小鼠海马脑切片中,重复上述实验,得到一致结果:7-CKA和DAAO仍仅特异性抑制CA2神经元的4-AP诱导PDS(图2k-q),对DG和下托神经元无显著影响(扩展数据图2i-p);
5.补充剂量依赖性实验:低剂量D-丝氨酸孵育可增强4-AP诱导的CA2神经元PDS(扩展数据图3a-c),高剂量D-丝氨酸则抑制该PDS(扩展数据图3d-f),与前述脑电图研究中不同剂量D-丝氨酸对癫痫发作的调控效应一致。
![]()
图2.海马D-丝氨酸耗竭抑制4-AP诱导的CA2区神经元PDS
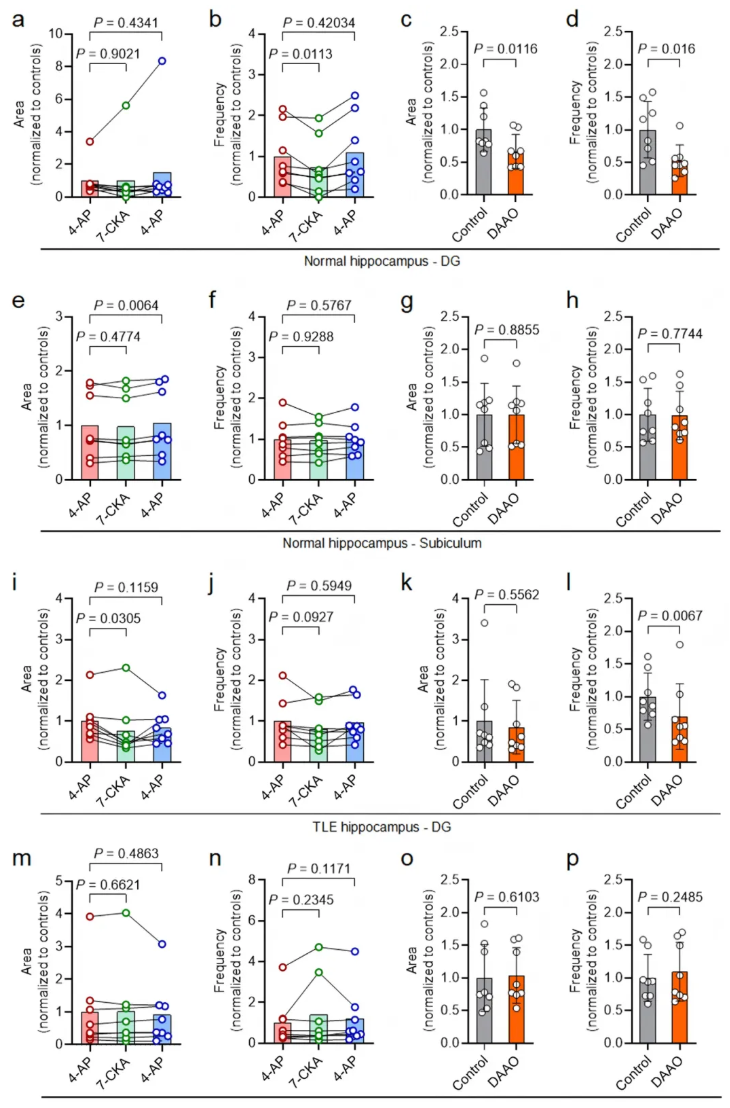
扩展数据图2.7-CKA和DAAO对DG和海马下神经元4-AP诱导的PDS的影响有限
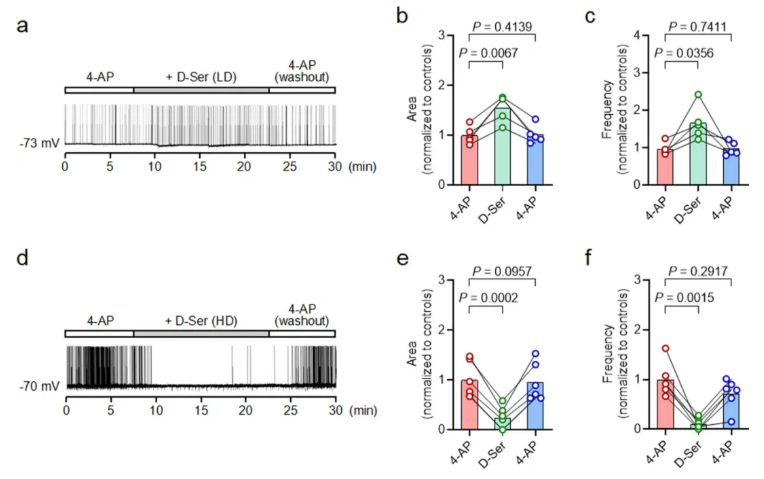
扩展数据图3.外源性D-丝氨酸对4-AP诱导的PDS的影响
04 星形胶质细胞来源的L-丝氨酸调控癫痫发作
研究发现,正常小鼠和TLE模型小鼠的海马体中,胶质原纤维酸性蛋白(GFAP)标记的星形胶质细胞均未检测到SR信号(图3a),提示星形胶质细胞仅作为L-丝氨酸产生者。
L-丝氨酸的调控路径为:星形胶质细胞通过丙氨酸-丝氨酸-半胱氨酸转运体1/2(ASCT1/2)释放 L-丝氨酸,神经元经 A型氨基酸转运体1/2(ATA1/2)摄取后转化为D-丝氨酸,再通过神经元Asc型氨基酸转运体1(Asc1)释放并结合 NMDAR(图3b)。
为验证其作用,研究通过反向微透析向海马体递送海人酸(KA)及上述转运体抑制剂,同时记录脑电图(EEG)并检测透析液丝氨酸水平(图3c-d)。
结果显示,KA灌注1小时可诱导5-7次HPDs(图3f-g);联合L-4-氟苯甘氨酸(L-4FPG)抑制ASCT1/2可完全阻断HPDs,补充外源性L-丝氨酸可逆转该抑制作用(图3h-i);进一步用谷氨酰胺抑制ATA1/2或BMS-466442阻断Asc1,均再次显著抑制HPDs(图3j-k),组间统计表明调控丝氨酸穿梭通路对癫痫发作有显著影响(图3l)。
透析液检测显示,L-4FPG可阻止KA诱导的L-丝氨酸和D-丝氨酸升高,即使存在L-4FPG,补充外源性L-丝氨酸仍可使D-丝氨酸上升,后续加入谷氨酰胺或BMS-466442则阻断该效应(图3m-n)。
综上,星形胶质细胞来源的L-丝氨酸通过丝氨酸穿梭通路,正向调控间质D-丝氨酸水平和癫痫发作活性。
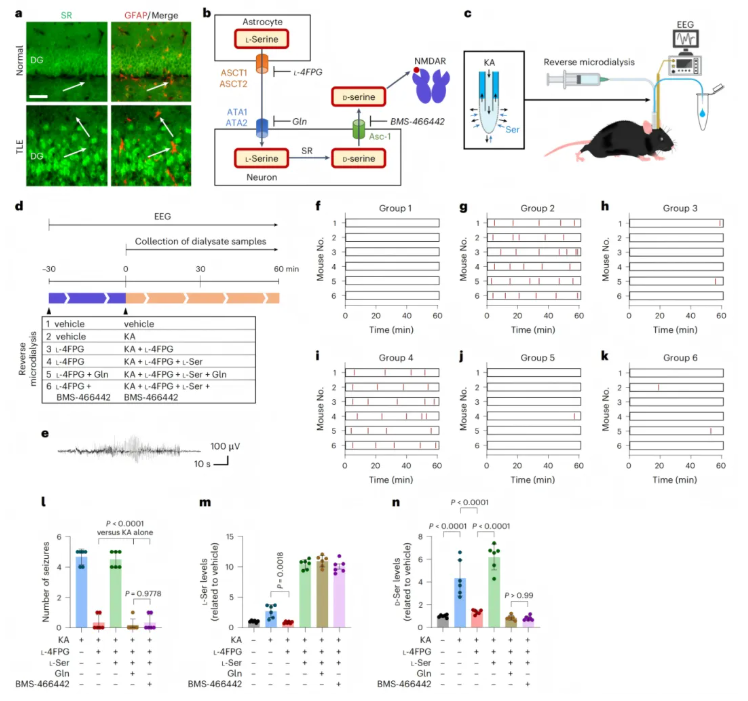
图3.星形胶质细胞来源的L-丝氨酸调节D-丝氨酸水平与癫痫发作
05 PSPH调控L-丝氨酸水平和癫痫发作活性
已知L-丝氨酸在星形胶质细胞中由糖酵解中间产物3-磷酸甘油酸经三步反应合成,依次由PHGDH、PSAT1和PSPH催化(图4a)。选择PSPH作为治疗靶点的依据为:敲低PSPH后,细胞内和细胞外L-丝氨酸水平的下降幅度显著大于敲低PHGDH或PSAT1(图4b-c、扩展数据图4a-f);PSPH在海马体中高表达(图4d)。
为验证PSPH表达与神经元活性的关联,向野生型小鼠注射戊四氮(PTZ)诱导海马体神经元激活,Western blot显示PSPH蛋白水平显著升高,预先注射水合氯醛(CH)可完全抑制该上调(图4e),证实PSPH上调由神经元激活引发。
TLE患者和慢性TLE小鼠的海马体星形胶质细胞中,PSPH水平异常升高,而PHGDH和PSAT1水平无显著变化(图4f-g、扩展数据图4g-j)。
通过AAV5-gfa104-PSPH-IRES-eGFP在正常小鼠海马体星形胶质细胞中过表达PSPH(PSPH OE),海马体胞外L-丝氨酸和D-丝氨酸水平显著升高(图4i-j),PSPH OE小鼠更易发生KA诱导的急性癫痫发作(图4k-n)。
相反,通过AAV5-gfa104-miPSPH-eGFP特异性敲低星形胶质细胞中的PSPH,可降低海马体胞外L-丝氨酸和 D-丝氨酸水平(图4o-q),并减轻PTZ诱导的急性癫痫发作严重程度(图4r-u)。
综上,PSPH是星形胶质细胞中L-丝氨酸从头合成的关键调控因子,靶向PSPH可通过降低丝氨酸水平减少癫痫发作。
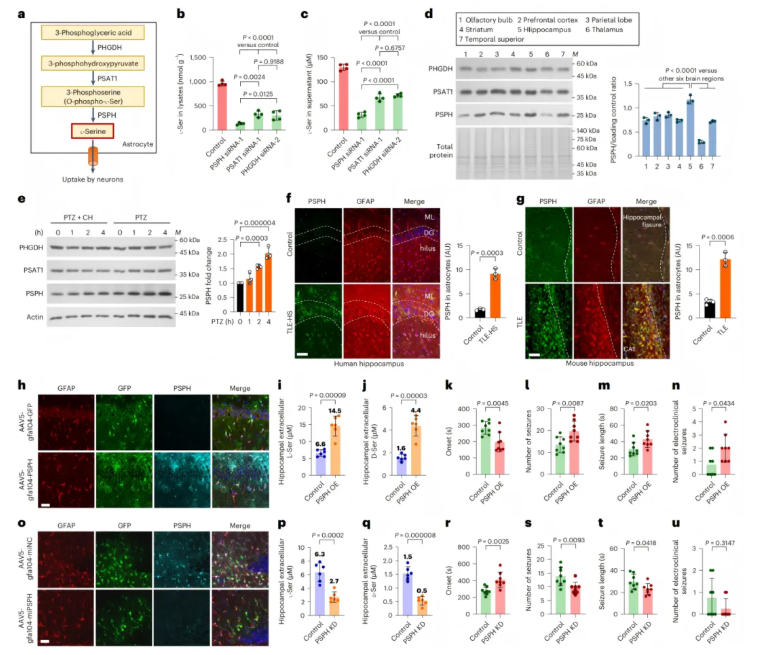
图4.PSPH在TLE中上调,并调节细胞外L-丝氨酸和D-丝氨酸以及癫痫发作
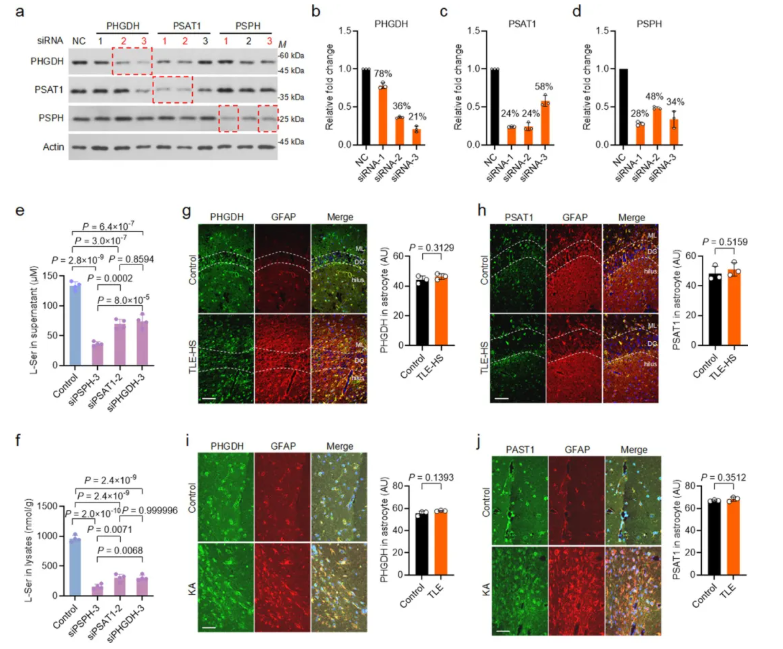
扩展数据图4.TLE中PHGDH和PSAT水平未发生变化
06 PSPH抑制剂的鉴定与表征
已知PSPH是星形胶质细胞L-丝氨酸从头合成的关键调控因子,但强效抑制剂尚未明确。研究通过高通量虚拟筛选(HTVS),从216万余个化合物中筛选出20个候选物,体外酶活性实验证实4种可剂量依赖性抑制PSPH活性(图5a-d、扩展数据图5a)。
在PTZ诱导的急性癫痫模型中,仅Z218484536表现出剂量依赖性抗癫痫效应,4mg/kg剂量时效果最佳(图5e-g);其余3种化合物无活性,而PHGDH抑制剂NCT-502的阳性对照结果,支持靶向丝氨酸合成通路的治疗潜力(图5h-p、补充图3a-f)。
进一步表征显示,Z218484536与PSPH的A51、D22等位点形成多重相互作用,微量热泳动(MST)分析证实其解离常数(Kd)约0.23μM,为竞争性抑制剂(图5q、扩展数据图5b-c)。该药药代动力学特性良好,腹腔注射4mg/kg后血浆暴露充分、半衰期2.7h,脑-血浆比0.33(可穿透血脑屏障),且安全性优异(扩展数据图5d-m)。
体外实验中,Z218484536抑制星形胶质细胞 L-丝氨酸释放及胞内合成的IC50分别为0.4μM和0.38μM(图5r-s);在KA-TLE小鼠模型中,连续腹腔注射可显著降低海马体L-丝氨酸和D-丝氨酸水平,且不影响外周血清氨基酸水平(图5t-u、扩展数据图5n-o)。
综上,Z218484536与PSPH结合亲和力强、血脑屏障穿透性好,体内外均能有效降低丝氨酸水平且安全性良好,是潜在抗癫痫候选化合物。
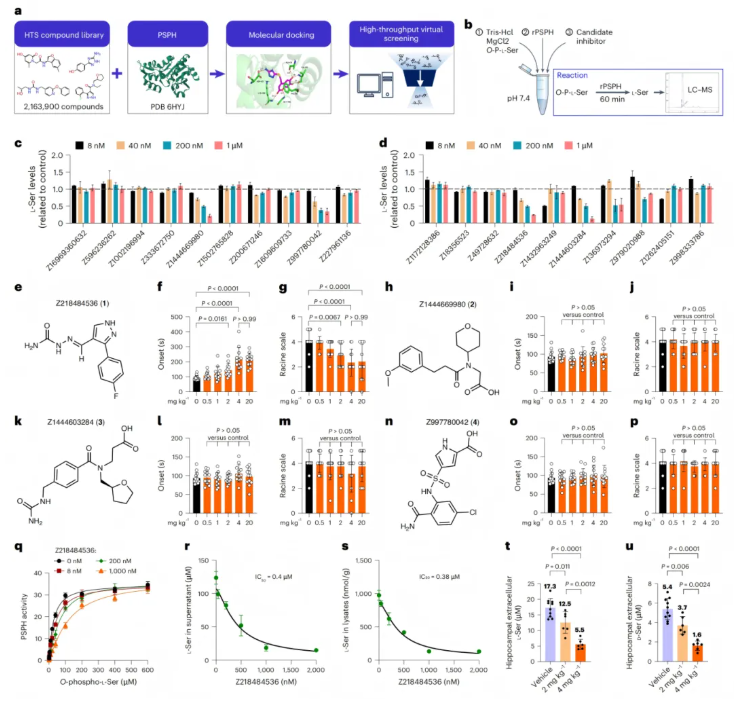
图5.虚拟筛选和实验验证确定了新的PSPH抑制剂
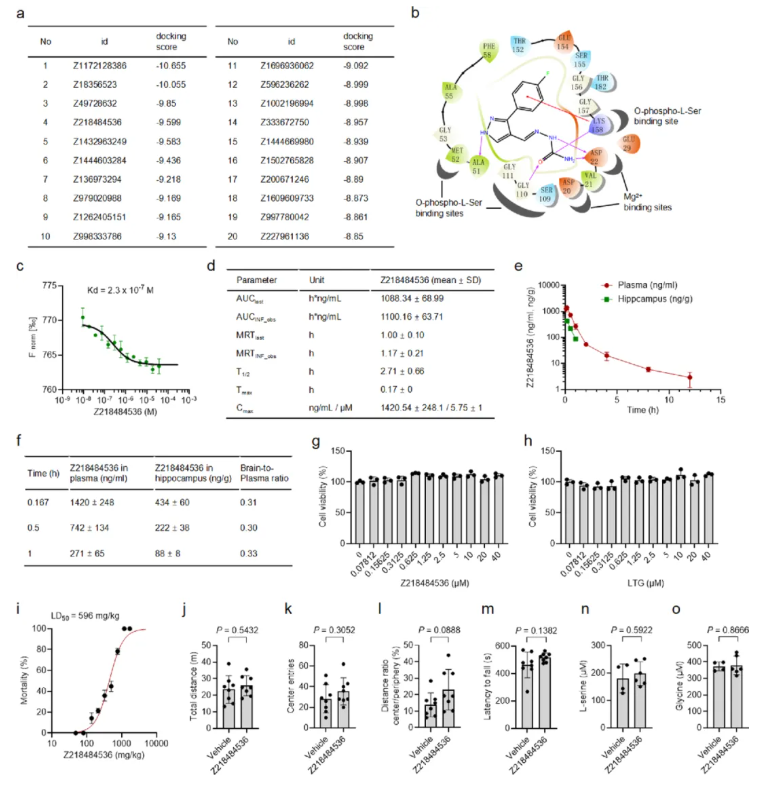
扩展数据图5.Z218484536的分子对接、药代动力学(PK)及毒理学数据
07 Z218484536的靶点选择性
为验证PSPH抑制剂Z218484536的特异性及无脱靶效应,研究开展多维度验证:
位点突变实验显示,Z218484536结合的PSPH氨基酸位点(D22、K158等)高度保守(扩展数据图6a);关键位点突变后,PSPH活性显著改变,且Z218484536与突变型PSPH的结合亲和力下降26倍,对L-丝氨酸的抑制作用消失(扩展数据图6b-f)。
靶标代谢组学分析表明,Z218484536仅影响7种代谢物,仅降低L-丝氨酸、甘氨酸水平并蓄积O-磷酸-L-丝氨酸,无广泛代谢紊乱(补充图4a-i);蛋白质组学显示其与PHGDH抑制剂分子作用不同,无共同靶点(补充图4j-m)。
体内实验证实,沉默PSPH后Z218484536的抗癫痫效应消失,且该效应可被预注射D-丝氨酸阻断(扩展数据图6k-n);其光亲和探针无法结合PSPH(补充图5a-e)。
磷酸酶面板检测显示,Z218484536仅在30μM时微弱抑制DUSP22,对其他24种磷酸酶无作用(补充图6)。
综上,Z218484536对PSPH具有高度选择性,通过特异性结合降低L-丝氨酸和D-丝氨酸水平,无明显脱靶效应。
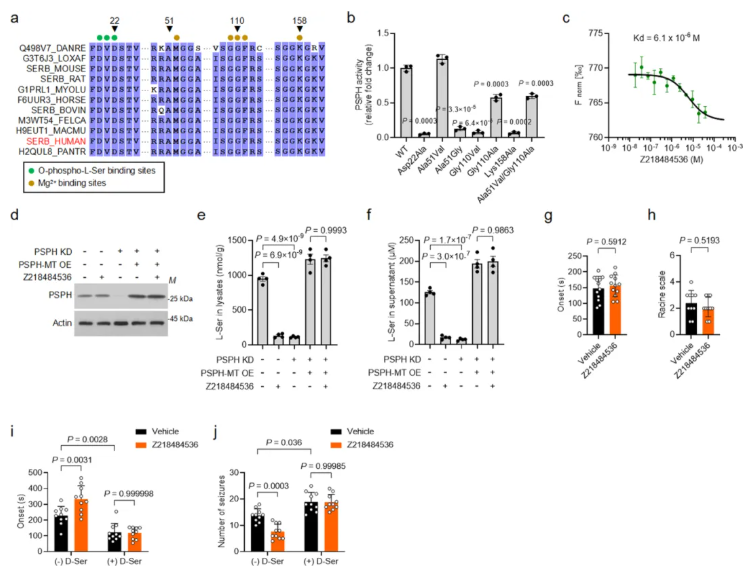
扩展数据图6.Z218484536的靶向结合
08 Z218484536抑制TLE小鼠的自发性癫痫发作
已知Z218484536在体外和急性模型中有效,需验证其对慢性TLE小鼠自发性癫痫的抑制作用及安全性。研究利用KA-TLE小鼠模型,KA诱导4周后 ,植入有线脑电图电极监测自发性临床电癫痫发作(SESs)(图6a-e)。先记录3周基线SES频率,随后进行7周载体、拉莫三嗪(LTG)或Z218484536处理(图6b-e)。
结果显示,载体组SES频率渐进升高(图6b, f, g);LTG组第1周显著降低SES频率,但效力逐渐下降(图6c, f, h);Z218484536可阻止SES频率升高但仍高于基线(图6d, f, i),而4mg kg⁻¹ 剂量可将SES频率降至0.44±0.15次/天,较基线降低75%(图6e, f, j)。
安全性方面,LTG和Z218484536(4mg kg⁻¹)均不导致小鼠体重下降(图6k);Z218484536(4mg kg⁻¹)处理组小鼠的肝肾功能损伤血清生物标志物(AST、ALT、BUN、肌酐)水平与溶媒组无显著差异(图6l-o)。
综上,Z218484536可有效抑制慢性TLE小鼠的自发性癫痫发作,且安全性良好,有望成为TLE的长期治疗干预手段。
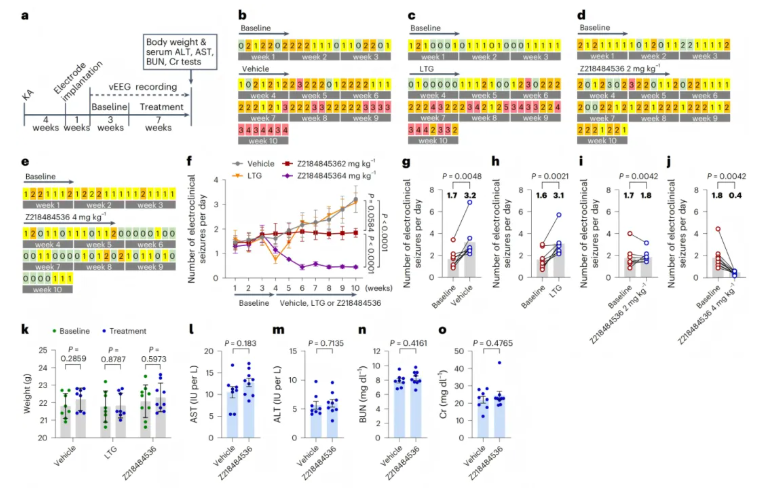
图6.Z218484536在慢性颞叶癫痫(TLE)KA小鼠模型中具有抗癫痫作用
09 Z218484536抑制TLE食蟹猴模型的癫痫棘波
已知食蟹猴TLE模型更贴近人类病理特征,且海马注射KA诱导的慢性癫痫状态无明显惊厥症状,故以癫痫棘波频率作为抗癫痫活性评估指标(扩展数据图7a)。
研究选用6只食蟹猴,建立KA-TLE模型;最后一次KA注射1个月后,记录脑电图以确定基线癫痫棘波频率(扩展数据图7b),三次基线记录显示棘波频率均稳定(扩展数据图7c)。
随后猴子每日腹腔注射溶媒或Z218484536,治疗2周后首次评估疗效,后续每月复查一次。
结果显示,溶媒组全程癫痫棘波频率无降低(扩展数据图7d);按种间剂量换算,初始给予1mg・kg⁻¹Z218484536 2周后,棘波频率较基线略有下降(扩展数据图7e);剂量增至2mg・kg⁻¹后,至3.5个月时棘波频率较基线降低80%(扩展数据图7e)。注射后1小时,Z218484536的平均血浆浓度为254.8ng/ml(扩展数据图7f)。
综上,Z218484536可有效降低TLE食蟹猴模型的癫痫活性,为其作为人类TLE潜在治疗药物提供了有力的非人灵长类动物实验证据。
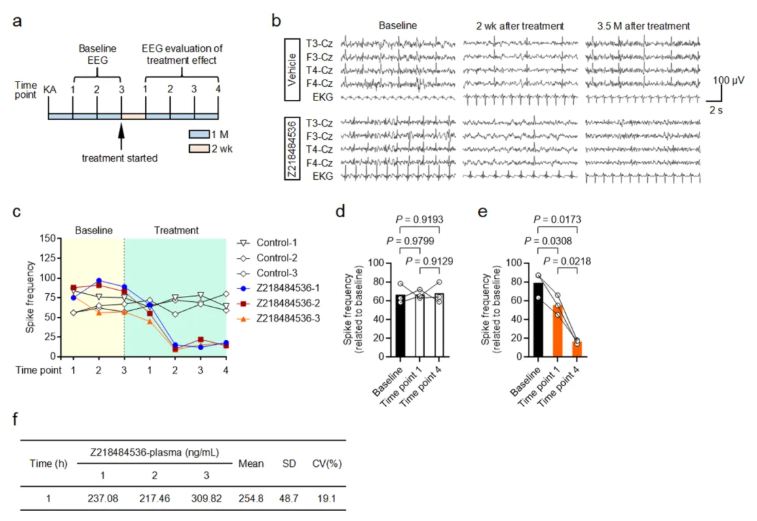
扩展数据图7.Z218484536在颞叶癫痫(TLE)食蟹猴模型中抑制癫痫放电
研究结论
本研究明确D-丝氨酸及其前体L-丝氨酸在TLE中起关键作用,通过遗传和药物遗传学抑制手段,证实降低星形胶质细胞来源的L-丝氨酸水平可发挥抗癫痫效应,同时确定PSPH为抗癫痫治疗的潜在核心靶点。
体外与体内研究表明,Z218484536是具有前景的先导化合物,需进一步优化其效力、选择性及药代动力学特征,有望成为TLE的新型治疗药物。
AQ700高通量靶标定量:是一种高通量靶标代谢组学分析方法,可检测15类的600多种代谢物,涵盖生物体内关键代谢通路核心代谢物、肠道菌群相关代谢物以及文献中报道的生物标志物。这些代谢物在生理稳态维持、病理机制调控等多种健康与疾病状态中发挥关键作用。AQ700采用高灵敏度的三重四极杆质谱仪,能够在较短时间内对样本中600多种代谢物进行精准、快速的定性与定量分析,实现对样本代谢谱的全面解析。