
英文标题:Medicinal cannabis plant extract (NTI164) modifies epigenetic, ribosomal, and immune pathways in paediatric acute-onset neuropsychiatric syndrome
中文标题:药用大麻植物提取物(NTI164)对儿童急性发作神经精神综合征的表观遗传、核糖体及免疫通路的调节作用
发表期刊:Neurotherapeutics
影响因子:6.9
研究背景
儿童急性发作神经精神综合征(Paediatric acute-onset neuropsychiatric syndrome,PANS)危害严重,核心特征为突发强迫症或严重进食限制,常伴随焦虑、抑郁、行为退化、认知下降等多种症状。其病程呈复发缓解型,感染或其他压力源易诱发病情反复,给患儿及家庭带来沉重负担。目前,尚无针对PANS的获批治疗方案,常规心理治疗或精神类药物难以控制多数患儿症状,治疗需求迫切。
大麻在医学中应用已久,大麻二酚(CBD)因无精神活性、耐受性佳且具抗炎作用成为研究热点。更有研究表明,包含植物全部成分的大麻提取物,凭借“随从效应”,其免疫调节活性优于单一成分,这类植物药的疗效也常优于孤立成分。
基于PANS是免疫与脑功能表观遗传紊乱的假说,本研究聚焦低四氢大麻酚(THC)的全谱药用大麻提取物NTI164,通过开放标签试验探索其对PANS患儿的安全性与有效性,借助多组学技术解析作用机制,为这一难治性疾病寻找新的治疗突破口。
研究结果
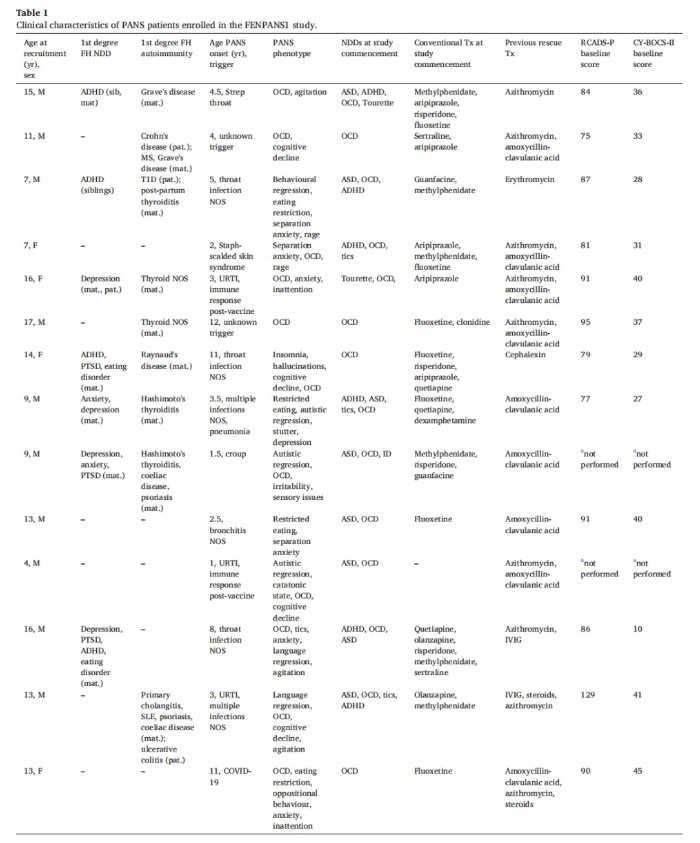
01-PANS患者的临床特征
本研究纳入14名PANS患儿,均来自澳大利亚三级神经科诊所,符合统一诊断标准(表1)。其中,家族史关联显著:64.3%患儿一级亲属有自身免疫病,50%有神经发育/精神疾病家族史,暗示着该疾病可能与遗传相关。
患儿发病平均5.2岁,85.7%由感染触发,均为复发缓解型病程,每年平均发作5次,病程迁延(发病至入组平均6.7年)。症状以强迫症为核心,半数以上伴随焦虑、认知下降,共病率高。除PANS外,患者还并发其他神经发育障碍或神经精神疾病,包括自闭症谱系障碍(ASD)和注意力缺陷多动障碍(ADHD)(表1)。
基线期时患儿病情严重,临床总体印象量表-严重程度(Clinical Global Impression-Severity,CGI-S)平均4.8分,焦虑、强迫症相关量表得分均表明症状显著(表1)。此外,既往治疗效果有限:所有患儿均接受过心理支持和多种药物治疗,部分使用过抗生素、类固醇或IVIg,但症状仍反复,亟待新的治疗方案(表1)。
表1 参加FENPANS1研究的PANS患者的临床特征
02-NTI164在PANS患者中的安全性与耐受性
经安全性与耐受性测试,12周口服NTI164治疗的PANS患儿,治疗期间所报告的不良事件均为轻至中度,以嗜睡、口干、食欲轻度增加最为常见,无严重不良事件发生;仅1例患儿因嗜睡短暂调整剂量,但无患儿因不良反应停药,且多数轻微症状随治疗推进自行缓解。患儿治疗前后的血压、心率等核心生命体征无显著波动,全部维持在儿童正常参考区间内。血常规、肝肾功能、电解质等实验室检查指标,在治疗全程未出现与药物相关的异常改变,均处于正常范围。
综上,低四氢大麻酚(THC<0.3%)全谱药用大麻提取物NTI164,在PANS患儿群体中展现出良好的安全性与耐受性,为该药物后续的临床研究和应用提供了可靠的安全性依据。
03-NTI164改善PANS相关临床症状
12周的NTI164治疗对PANS患儿的临床症状展现出显著改善效果,所有核心评估指标均与图1数据高度契合:基线期时,CGI-S平均4.8分,呈显著患病状态;治疗后降至3.3分,病情严重程度明显减轻(图1a)。情绪调节、强迫症、抽动、ADHD相关症状及生活质量均实现统计学意义上的显著改善,其中抽动症状(YGTSS)和情绪调节(RCADS-P)改善最为突出(图1b、d),强迫症(CYBOCS-II,图1c)、ADHD(图1e)及生活质量(EQ-5D-Y,图1f)也均有明显改善。
RCADS-P亚域分析显示,患儿社交恐惧、惊恐障碍、重度抑郁、分离焦虑、广泛性焦虑等情绪问题均得到全面缓解,无单一症状遗漏。高比例患儿及监护人选择继续治疗,进一步印证了NTI164的临床获益与接受度,为PANS这一难治性疾病提供了有效的症状控制方案。
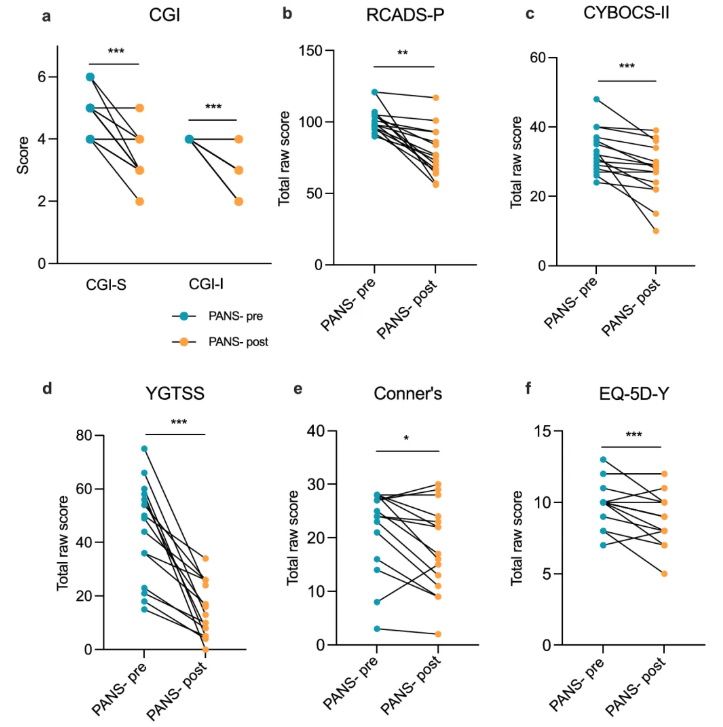
图1 经过12周NTI164治疗后(PANS-post),PANS患儿的基线临床调查评分(PANS-pre)得到显著改善
04-PANS患儿存在免疫细胞转录组特征失调,且可被NTI164逆转
研究通过多维度转录组分析发现,PANS患儿的免疫细胞存在显著转录组失调,而NTI164能有效逆转这一异常(图2、图3)。具体而言,患儿基线期时,血浆中BDNF和IL-18水平显著升高,表明免疫与神经功能紊乱(图2a-b);bulk-RNA测序显示,患儿全血中7710个基因表达异常,核糖体形成、翻译功能相关通路下调,细胞信号与转录通路上调,且PCA分析明确区分患儿与健康人群,经NTI164治疗后,这些通路异常均得到针对性逆转(图2c-e)。
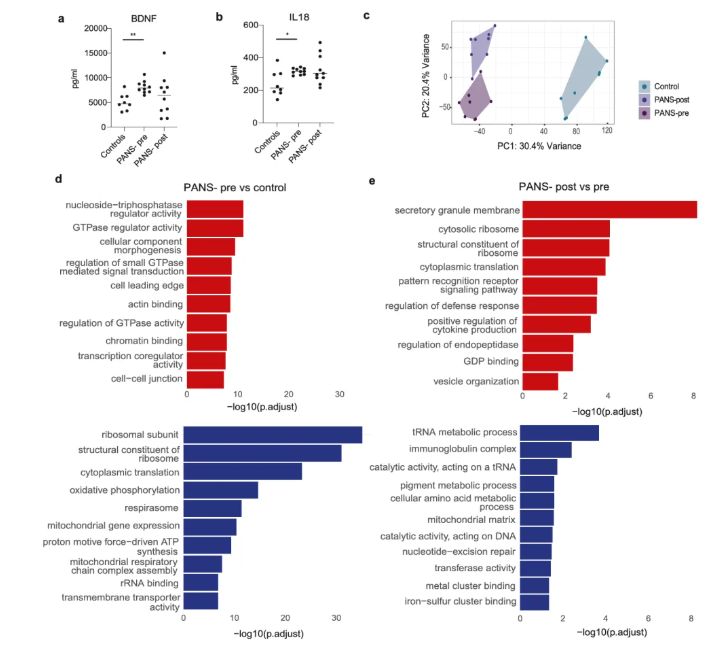
图2 NTI164治疗12周后PANS患儿血浆免疫标记物和全血批量转录水平的变化
单细胞层面进一步揭示,患儿11种免疫细胞中,中性粒细胞、单核细胞、T/B细胞等的免疫防御、细胞因子产生通路普遍下调,核糖体通路呈现细胞特异性异常(图3a、c);而NTI164能精准上调防御反应相关的关键基因(如GBP1、IFIT3),修复免疫细胞功能(图3d、e)。这一系列结果表明,免疫细胞转录组失调是PANS的核心生物学特征,而NTI164通过调节免疫与核糖体相关通路,为PANS提供了潜在治疗靶点。
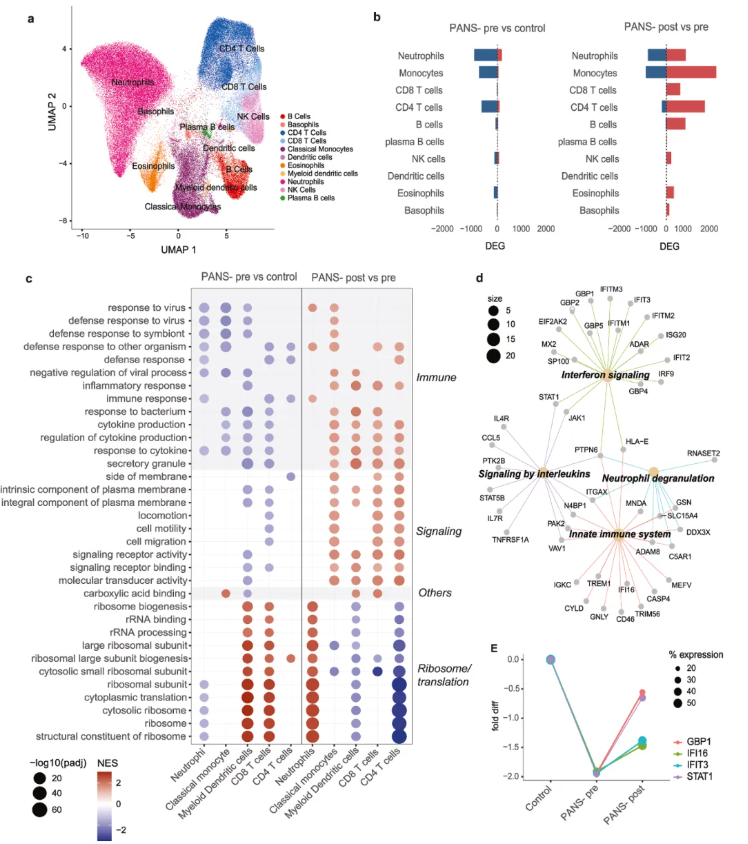
图3 单细胞RNA测序显示,PANS患者存在免疫和表观遗传功能障碍,且该障碍可被NTI164逆转
05-PANS患儿蛋白质组和磷酸化蛋白质组中的免疫及表观遗传通路可被NTI164调控
PANS患儿在蛋白质组、磷酸化蛋白质组及DNA甲基化层面存在显著免疫与表观遗传失调,而NTI164能有效逆转这些异常(图4、图5),结果如下:
蛋白质组层面,基线时免疫相关通路上调、表观遗传及核糖体通路下调(图4b),NTI164治疗后可双向修正这些通路,且“染色质结合”通路中组蛋白结合、DNA结合相关蛋白的异常表达得到恢复(图4c)。
磷酸化蛋白质组层面,患儿基线时,钙粘蛋白结合、蛋白激酶等通路上调,GTP酶、转录相关通路下调(图5a),NTI164能针对性逆转这些异常,尤其修复了组蛋白激酶活性相关蛋白的磷酸化紊乱(图5b)。
DNA甲基化层面,患儿基线时,异常通路集中于DNA转录(图5c),经NTI164治疗后,差异甲基化区域转向细胞因子活性相关通路,涉及趋化因子、白细胞介素等关键基因(图5c-d)。
这些结果表明,NTI164可通过调控蛋白质表达、磷酸化修饰及DNA甲基化,多维度修复PANS患儿的免疫与表观遗传紊乱。
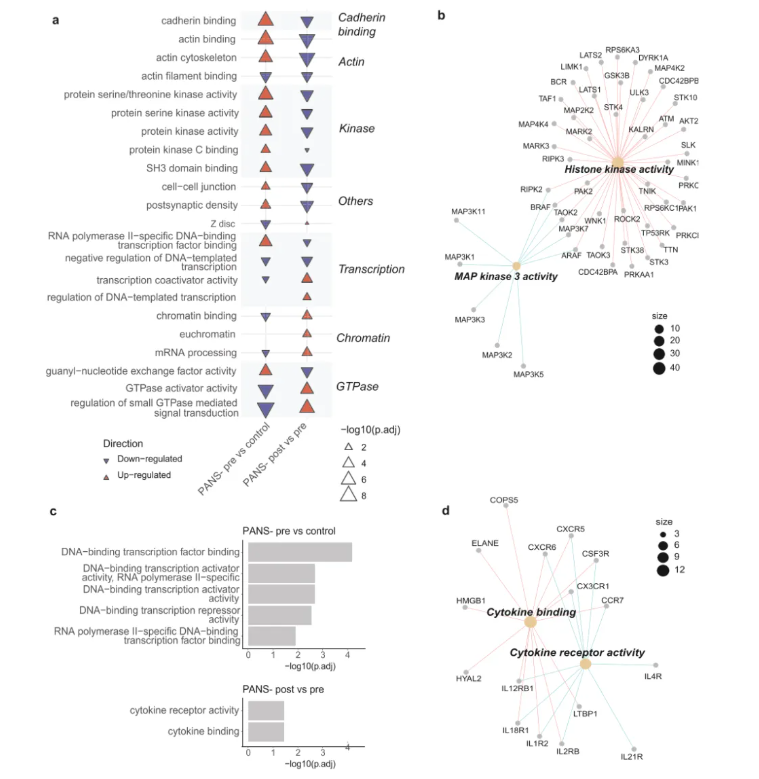
图4 PANS患儿磷酸化蛋白质组和DNA甲基化组中存在的免疫与表观遗传失调,可被NTI164逆转
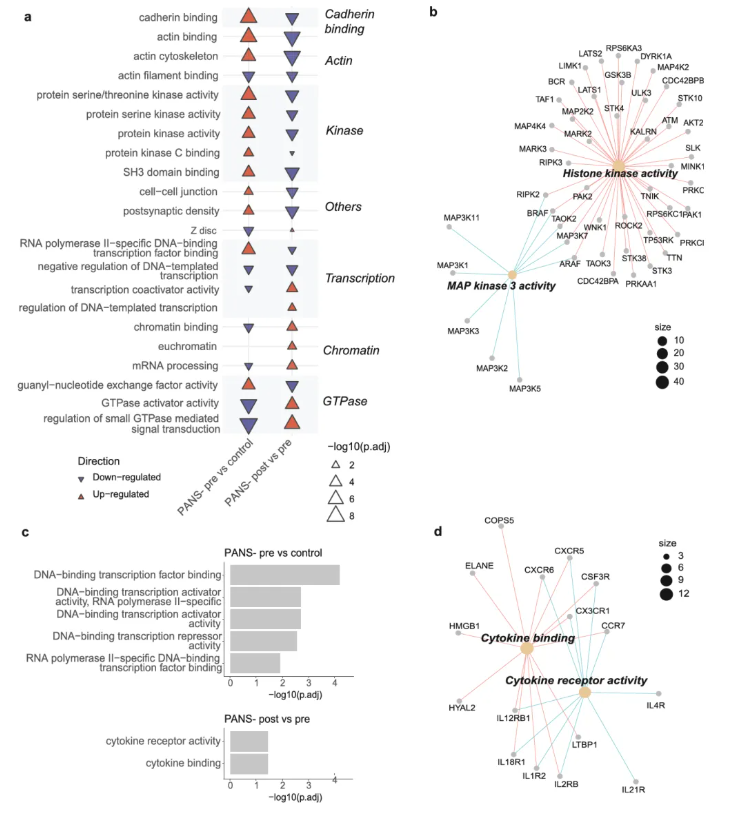
图5 PANS患儿磷酸化蛋白质组与DNA甲基化组中存在的免疫及表观遗传失调,可被NTI164逆转
研究总结
本研究通过一项针对14名慢性复发性PANS患儿的开放标签试验,探索了低四氢大麻酚(THC<0.3%)全谱药用大麻提取物NTI164的安全性与有效性,并结合多组学技术解析其作用机制。结果显示,为期12周的NTI164口服治疗耐受性良好,显著改善了患儿的临床总体严重程度、强迫症、情绪调节、抽动、ADHD症状及生活质量,85.7%的患儿及监护人选择继续治疗,且多组学分析证实PANS患儿存在免疫、表观遗传、核糖体及信号通路的广泛失调,而NTI164可通过双向调节这些异常通路(如修复免疫细胞防御功能、纠正DNA甲基化紊乱、逆转核糖体翻译通路异常等)发挥作用,表明NTI164有望成为PANS的疾病修饰疗法,也为其他涉及免疫与表观遗传失调的神经发育障碍提供了新的治疗方向。
全景修饰蛋白质组学:作为一种蛋白质翻译后修饰(PTM)研究技术,仅需一份生物样本,即可实现对样本中的多种蛋白质修饰类型进行鉴定与定量分析,能够一次性精准鉴定数千种蛋白质上的上万个修饰位点,有效规避了传统方法因单次仅关注一种修饰类型而导致的大量关键修饰信息遗漏问题。百趣生物推出的全景修饰蛋白质组学技术,目前已实现对多种重要蛋白质翻译后修饰类型的覆盖,包括磷酸化、乙酰化、乳酸化、泛素化、琥珀酰化等。从生物学功能层面来看,这些翻译后修饰可通过改变蛋白质的理化性质、空间构象及活性状态,在细胞信号传导通路调控、物质代谢网络平衡、疾病发生发展的分子机制等核心生理病理过程中发挥不可替代的关键调控作用。
单细胞转录组测序:是在单个细胞水平进行高通量测序的技术,能够有效解决细胞异质性,有助于发现新的稀有细胞类型,深入了解细胞生长过程中的表达调控机制。利用微流控系统通过序列标签(barcode和UMI)区别群体中的不同细胞和转录本,获得单细胞水平的基因表达谱。