
英文标题:Immune–epithelial–stromal networks define the cellular ecosystem of the small intestine in celiac disease
中文标题:免疫-上皮-基质网络决定了乳糜泻患者小肠的细胞生态系统
发表期刊:Nature Immunology
影响因子:27.6
研究背景
对于乳糜泻(Celiac Disease, CD)患者而言,终身严格规避麸质——一种存在于小麦、大麦等谷物中的蛋白质,是目前唯一的治疗手段。然而,许多患者即便坚持无麸质饮食,症状仍未改善,肠道内可能仍存在隐匿性病变。为何 “忌口” 无法彻底修复损伤?疾病背后还潜藏着哪些未知机制?
来自牛津大学等机构的科学家们,运用单细胞转录组学(对35名参与者的86,442个免疫、实质和上皮细胞进行RNA测序)和空间转录组学(20名参与者)技术,绘制出了小肠组织高分辨率的细胞图谱及细胞空间定位图谱。这项研究首次全面揭示了乳糜泻患者小肠内免疫细胞、上皮细胞和基质细胞之间复杂的相互作用网络,不仅发现了疾病状态下持久存在的“免疫-上皮瘢痕”,还鉴定出关键的致病性免疫细胞群及其独特的分子标识,为开发更有效的治疗甚至预防策略提供了全新的靶点和思路。
实验设计
对35名参与者(21例乳糜泻患者,包括16名儿童和5名成人,其中涵盖活动性乳糜泻(ACD)和经治疗的乳糜泻(TCD)患者;14名健康对照(HC),包括5名儿童和9名成人)的十二指肠上皮细胞、免疫细胞及实质细胞进行了单细胞RNA测序(scRNA-seq),共获取86,442个细胞的测序数据;同时对20名参与者的十二指肠活检样本进行了空间转录组学分析(图1)。
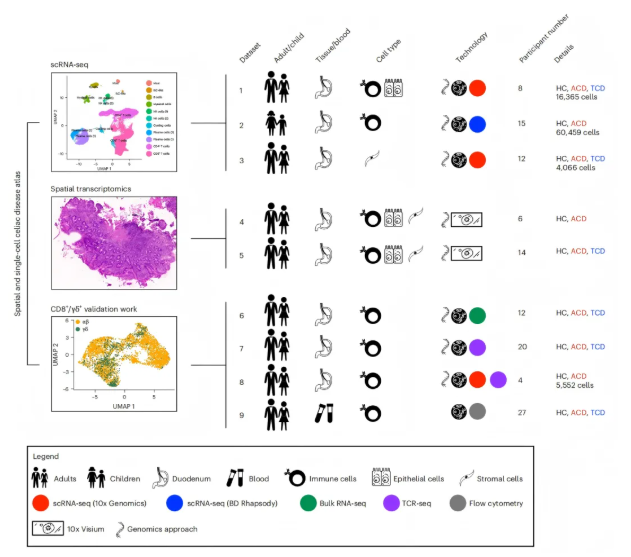
图1. 研究方案
研究结果
1、上皮细胞重塑
乳糜(CD)患者的肠上皮细胞存在显著重塑:上皮群体向祖细胞状态偏移,转运放大(TA)细胞比例增加,干细胞、TA细胞和早期肠细胞等祖细胞相关的UMAP区域富集,成熟肠细胞减少,且这一现象在经治疗的CD(TCD)中仍持续存在,同时ACD和TCD患者中上皮细胞的活跃分裂增多(图2a-f)。
功能上,成熟肠细胞负责代谢、营养吸收等功能,而早期上皮细胞和TA细胞缺乏这些通路。ACD患者成熟肠细胞中,脂质(如FABP2)、碳水化合物(如 ALDOB)、胆固醇等的加工吸收相关基因集下调,导致吸收能力降低;TCD中多数转录变化恢复,但果糖代谢和脂质分解等仍受影响(图2g)。
此外,ACD患者上皮细胞以干扰素应答为主导,所有上皮谱系均上调经典及非经典HLA分子(如HLA-E),以及I型、II型干扰素刺激基因(如STAT1),涉及抗原呈递、免疫应答等多个通路,且部分变化具有细胞类型特异性(图2h)。
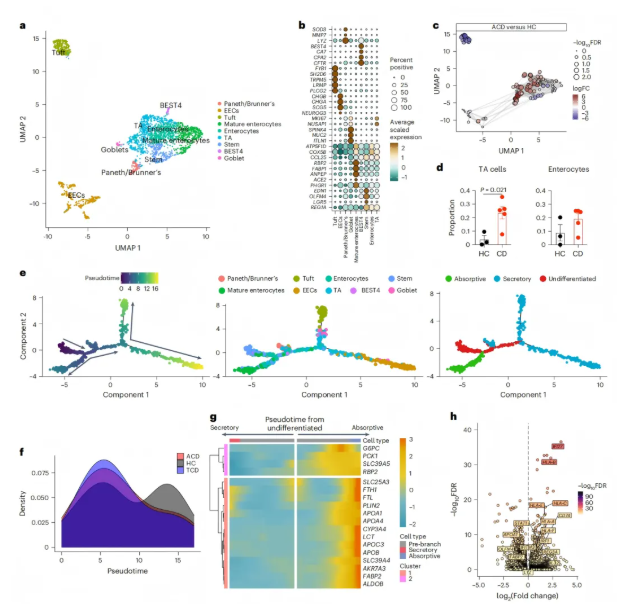
图2. 乳糜泻(CD)中的上皮细胞(ECs)
2、免疫细胞异常
在CD患者的肠道中,免疫细胞存在明显异常。其中,Tfh样CD4⁺T细胞数量增加,该细胞群表达 PD-1(PDCD1)、ICOS、CXCL13等分子,其表型与肠道驻留的麸质特异性CD4⁺T细胞相似,且富集了在麸质特异性CD4⁺T细胞HLA-DQ2.5⁺TCR库中常见的TRBV7-2 V基因(图3)。空间转录组学分析显示,这类Tfh样CD4⁺ T细胞主要富集于淋巴聚集区(LA),与B细胞等形成局部的免疫相互作用网络。
同时,调节性T细胞(Treg)在活动性乳糜泻(ACD)患者中数量也有所增加,这一现象在成人和儿童群体中均存在(图3h-i)。不过,结合转录因子及调节子的表达分析来看,Treg细胞的功能可能受损,例如其与Tfh样细胞之间的调控平衡被打破,难以有效抑制过度的免疫反应,进而可能加剧肠道的炎症损伤。
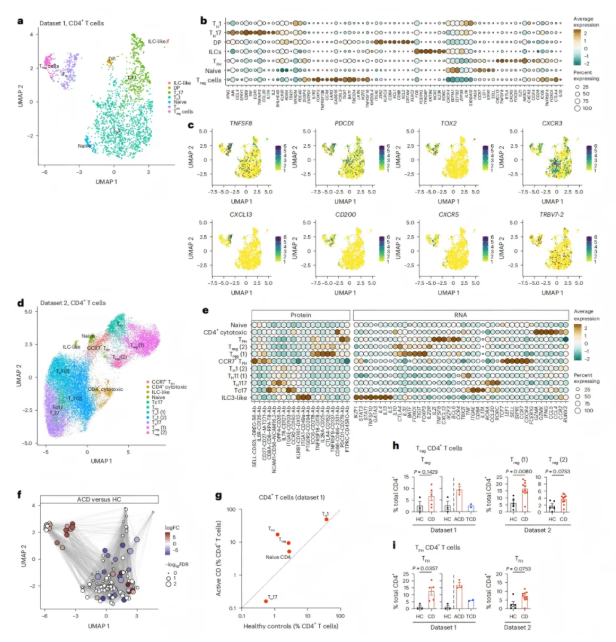
图3. 乳糜泻(CD)中的CD4⁺T细胞
除CD4⁺T细胞外,CD8⁺T细胞同样存在显著异常。其中,TRM(2)亚群扩增,具有细胞毒性(GZMA⁺)、组织驻留(ITGAE⁺CXCR6⁺)特征,定位于绒毛顶端,与肠细胞共定位(图4-5)。CD8⁺T细胞诱导的上皮损伤被认为是通过TCR非依赖性机制介导的,单细胞TCR检测显示,组织驻留细胞群之间存在预期的克隆重叠(图5e)。此外,几个高频TRBV片段(>1%总克隆)在CD中过表达(图5f),其中TRBV28基因频率显著升高(ACD中占10%,而HC中仅为2%),且这一变化在治疗后仍持续存在(图5g-h)。
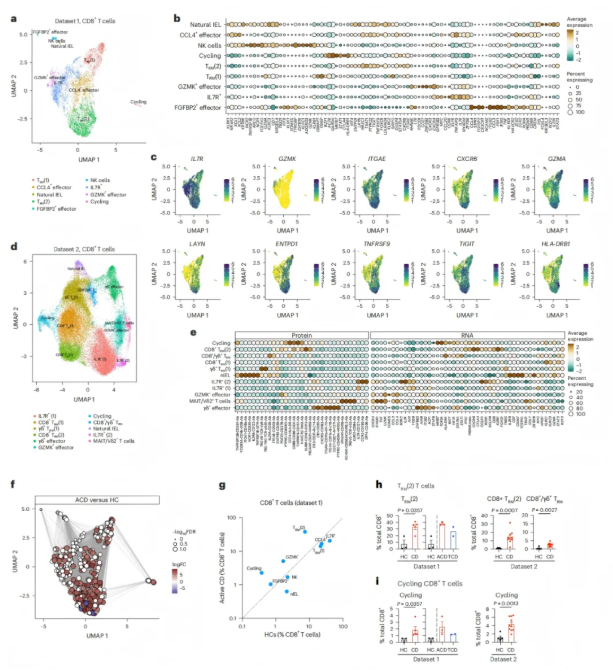
图4. 乳糜泻(CD)中CD8⁺T细胞的亚群分类、标志物表达及富集特征
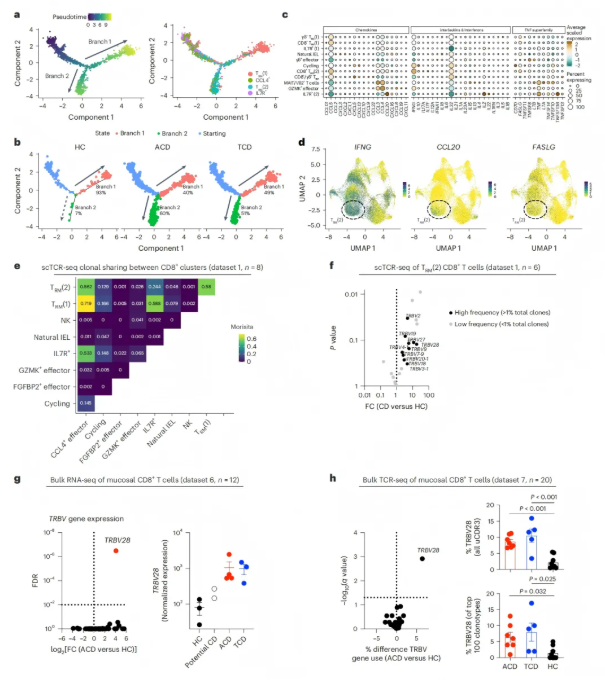
图5. 乳糜泻(CD)中CD8⁺T细胞的分化轨迹、功能分子及TCR谱系特征
3、空间位置解析
空间转录组学分析显示,十二指肠粘膜内存在13个不同的转录区域,这些区域分别对应隐窝-绒毛轴的不同区室、基质细胞富集区、多个固有层区域等,其中免疫细胞浸润以浆细胞和淋巴聚集(LA)为主要特征(图6a-b)。
进一步的空间区域分析重现了此前已明确的十二指肠粘膜关键转录区域(图7a-b),其中增生相关区域主要富集于隐窝基底部、MUC5AC⁺和PGC⁺上皮细胞所在区域、浆细胞密集的免疫富集区以及淋巴聚集区(LA)等部位(图7c-f)。值得注意的是,淋巴聚集区(LA)作为活动性乳糜泻(ACD)的特异性结构,富集了Tfh细胞与B细胞的相互作用,且CXCL13-CXCR5信号活跃,提示其可能是麸质抗原呈递的核心区域。
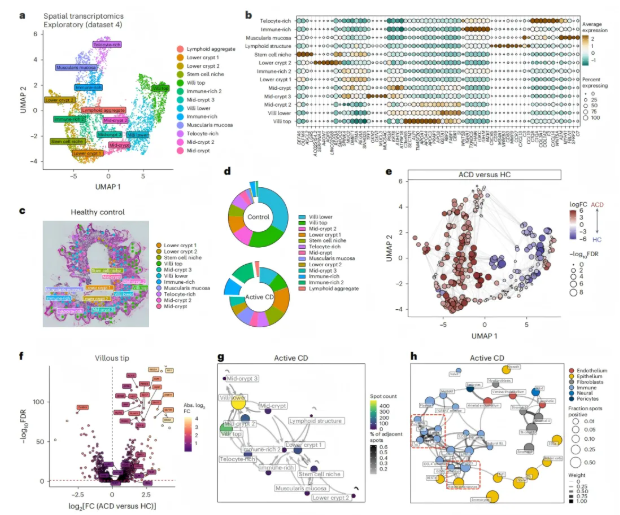
图6. 肠粘膜的空间转录组揭示免疫细胞位置
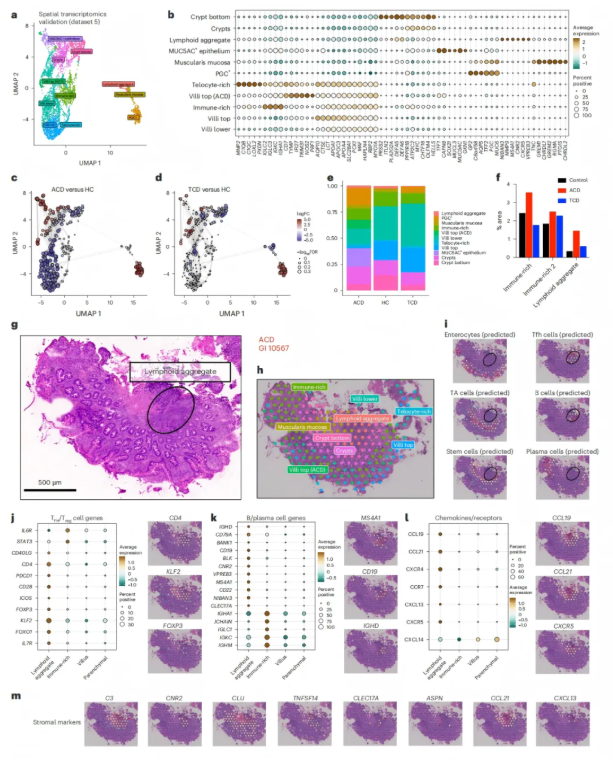
图7. Tfh–B细胞相互作用在乳糜泻的LA中高度富集
4、治疗抵抗性“免疫瘢痕”
信号通路表达呈现区域依赖性特征,表明黏膜信号传导回路具有高度局域化特性(图8a),在CD特异性淋巴结(LA)中,涉及CXCR5-CXCL13、CCR7-CCL19、CXCR4及整合素ITGB2与ITGAM的趋化因子信号通路显著上调。绒毛顶端区域显示出对T细胞及免疫相关通路的区域特异性激活,CD8⁺T细胞参与趋化因子和II型干扰素信号传导,包括祖细胞EC与增殖中的CD8⁺T细胞之间的CCR9-CCL25轴相互作用(图8b)。Wnt信号通路在富含端细胞的区域及其邻近绒毛结构中富集(图8a)。
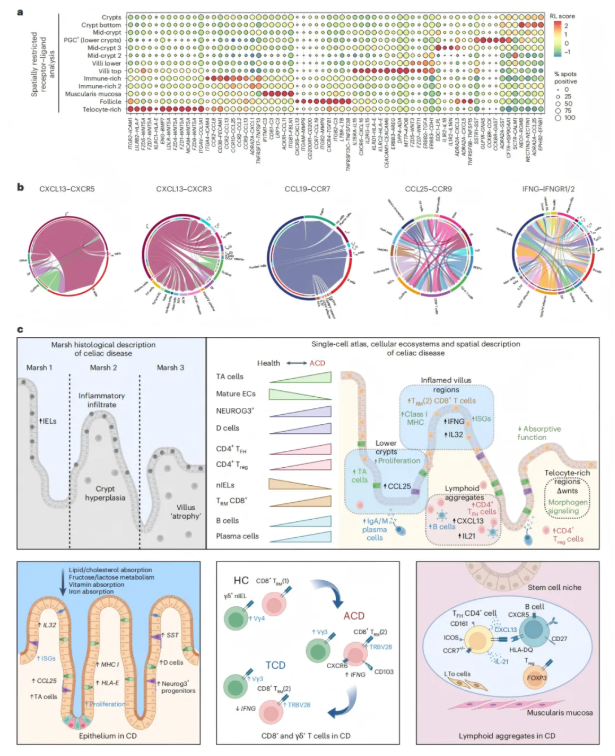
图8. CD粘膜免疫应答的空间分辨模型
研究意义
本研究结合单细胞RNA测序(scRNA-seq)、空间转录组学等多维度技术手段,成功绘制出乳糜泻(CD)患者小肠的细胞图谱,为深入解析疾病的分子机制提供了全面且精细的细胞层面视角。研究不仅揭示了CD患者在发育阶段的免疫应答特征,明确了不同细胞群体在疾病发生发展中的动态变化,还通过对治疗抵抗相关的细胞状态及信号通路分析,阐明了治疗抵抗背后的细胞基础,为理解为何部分患者对现有治疗反应不佳提供了关键线索。同时,研究发现的特定细胞亚群、异常激活的信号通路(如CXCR5-CXCL13轴、II型干扰素通路等)以及差异表达基因,不仅为开发新的靶标治疗药物提供了潜在靶点,也为寻找可用于疾病早期诊断、病情监测及疗效评估的生物标志物奠定了基础。
单细胞转录组测序,是在单个细胞水平进行高通量测序的技术,能够有效解决细胞异质性,有助于发现新的稀有细胞类型,深入了解细胞生长过程中的表达调控机制。利用微流控系统通过序列标签(barcode和UMI)区别群体中的不同细胞和转录本,获得单细胞水平的基因表达谱。
空间转录组测序,通过对样本包埋切片并与检测芯片结合,利用序列标签(spatial barcode和UMI)区别不同细胞的空间位置,可高效检测组织中空间原始位置上的基因表达模式,两者联合可同时获取细胞类型、功能及空间定位信息。
若您对文中所述的“单细胞转录组测序/空间转录组测序”服务感兴趣,百趣生物可提供专业技术服务,欢迎联系咨询!