
英文标题:MCT1-governed pyruvate metabolism is essential for antibody class-switch recombination through H3K27 acetylation
中文标题:MCT1控制的丙酮酸代谢对于通过H3K27乙酰化进行的抗体类别转换重组至关重要
发表期刊:nature communications
影响因子:15.7
研究背景
免疫细胞的激活需要伴随代谢重编程,以满足其快速增殖和功能发挥所需的生物能量与合成需求。作为细胞能量的主要来源,葡萄糖通过糖酵解生成丙酮酸,在氧气充足时,丙酮酸进入线粒体参与三羧酸循环生成乙酰辅酶A;在低氧条件下,则通过乳酸脱氢酶转化为乳酸(Warburg效应)。然而,乳酸的积累需通过单羧酸转运蛋白(Monocarboxylate transporter, MCT)排出胞外,以维持糖酵解的持续进行。MCTs属于溶质载体转运蛋白家族,在免疫细胞的发育、稳态、分化及激活中起关键作用,其功能失调与多种免疫疾病密切相关,如痛风、哮喘、阿尔茨海默病等。
MCT1负责转运乳酸和丙酮酸等关键代谢物。已有研究表明,MCT1缺陷会削弱活化CD8+T细胞的增殖与代谢,但其在B细胞中的具体功能仍不明晰。B细胞在疫苗接种后,通过抗原诱导的B细胞受体(BCR)信号或BAFF受体信号,依赖PI3K-AKT和PKC-β通路激活糖酵解并快速增殖,同时上调葡萄糖转运蛋白GLUT1和氧化代谢。在激活的B细胞中,部分细胞会经历抗体类别转换重组(Class-switch recombination, CSR),生成免疫球蛋白G(IgG)抗体,这一过程依赖B细胞特异性的激活诱导性胞苷脱氨酶(Activation-induced cytidine deaminase,AID或AICDA)的绝对不可或缺性。尽管NF-κB信号通路、转录因子、细胞因子及组蛋白修饰等因素已被证实参与CSR中AID表达的上调,但MCT1驱动的代谢调控与CSR及抗体生产之间的功能关联尚未被揭示。
研究结果
1、MCT1转运蛋白是CSR所必需的
根据研究前期的PCR定量分析与ImmGen数据库的结果,单羧酸转运家族中的Mct1被作为本研究的重点对象。为评估MCT1及单羧酸信号在B细胞活化与功能中的作用,B细胞特异性Mct1缺陷小鼠(Mct1f/f Mb1Cre)被构建。
用T细胞依赖性抗原NP33-KLH免疫后,B细胞Mct1缺失小鼠的NP特异性IgG抗体产生显著受损,而IgM抗体未受影响(图1a-c);并且,Mct1缺陷小鼠产生的NP特异性IgG抗体对抗原的亲和力较弱(图 1d)。当使用T细胞非依赖性抗原NP-Ficoll免疫后,Mct1缺失主要导致IgG3抗体产量减少,而IgM水平不变。以上结果表明,Mct1缺陷特异性破坏IgG抗体应答,由此推测,受损的CSR伴随生发中心反应的改变可能导致IgG抗体的减少。
为了验证上述观点,绵羊红细胞(SRBC)免疫小鼠中的生发中心B细胞(GCBC)被监测。值得注意的是,Mct1的缺失导致GCBC的分化减少(图1e-f);与Mb1Cre小鼠相比,Mct1f/fMb1Cre小鼠的GCBC数量和大小显著减少(图1g,左);在GC区中,Ki67阳性的GCBC也显著减少(图1g,右);IgG1阳性但非IgM阳性的B细胞比例在Mct1缺失后显著减少(图1h-i)。进一步验证,在体外,脂多糖(LPS)和白细胞介素-4(IL-4)驱动的B细胞CSR方案被应用后,Mct1缺失导致IgG1阳性B细胞的比例显著降低(图1j-l);此外,当广谱或是特异性MCT1抑制剂分别被用作处理时,LPS和IL-4刺激的CSR反应受到抑制(图1m-o)。因此,MCT1转运蛋白对于CSR至关重要。
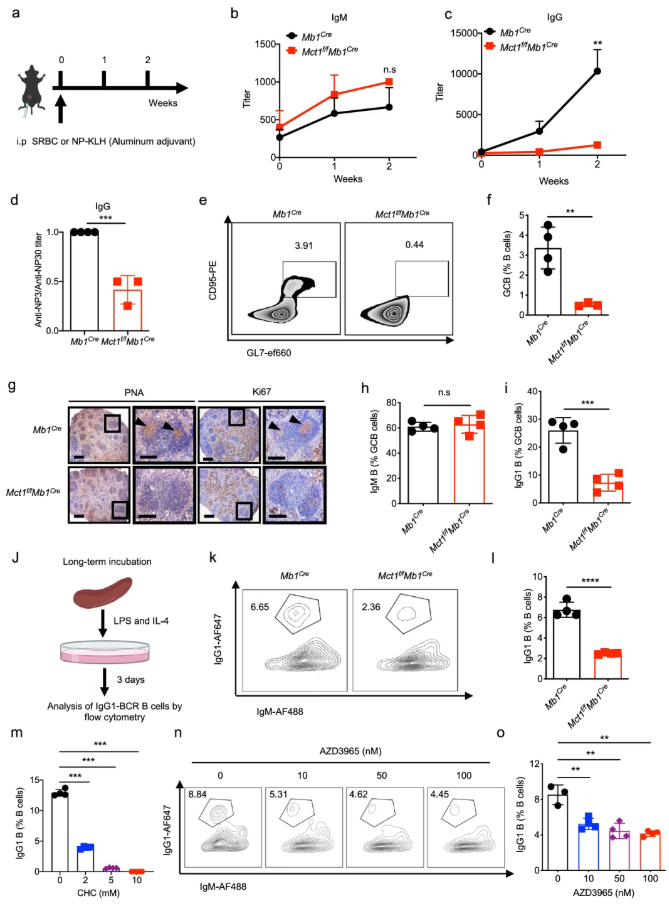
图1. B细胞中缺乏Mct1会抑制CSR
2、Mct1缺陷的B细胞糖酵解受到严重抑制
已知,在爆发性增殖和CSR事件中,B细胞的糖酵解非常活跃。然而,Mct1缺陷的B细胞中糖酵解效率显著降低(图2a);并且,Mct1缺陷会抑制糖酵解关键酶——己糖激酶2(HK2)表达的上调,且不受葡萄糖的剂量的影响(图2b);此外,作为糖酵解限速步骤的己糖激酶(HK),其活性在Mct1缺陷的B细胞中也受到抑制(图2c)。由于乳酸和丙酮酸既是糖酵解的中间产物,也是MCT1转运蛋白的底物,所以上述现象可能是因为乳酸在B细胞内积累所致。然而,Mct1缺陷的B细胞胞内的乳酸水平并未增加,而培养上清中的乳酸水平反而显著降低(图2d-e);重要的是,在同一批B细胞中,胞内和胞外的丙酮酸水平均显著降低(图2f-g)。基于以上结果,MCT1的缺失导致B细胞的糖酵解过程受到严重的抑制,但其机制还仍需进一步探究。
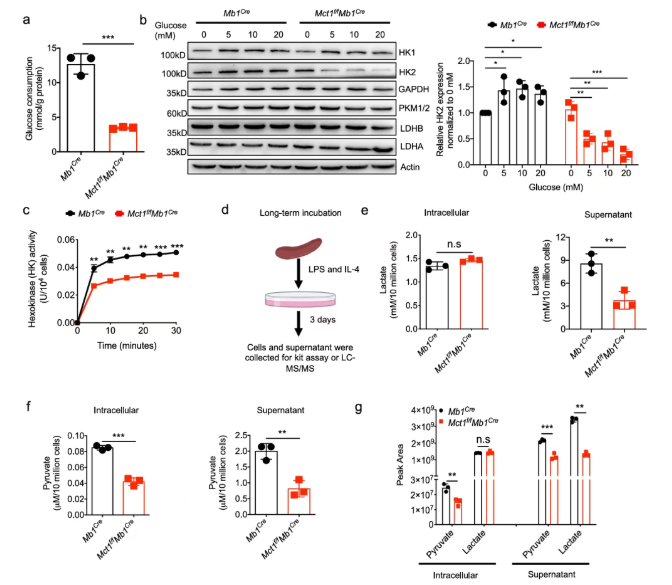
图2. Mct1缺陷抑制了B细胞的糖酵解代谢
3、Mct1缺陷B细胞的葡萄糖代谢从糖酵解转移到OXPHOS
为了探究乳酸和丙酮酸在Mct1缺陷B细胞中的代谢路程,葡萄糖同位素示踪法被应用于CSR的B细胞中(图3a-b)。有趣的是,在所有三个时间点(30、60和180分钟),Mct1缺陷的B细胞中的乳酸和丙酮酸在胞质中均出现了瞬时积累(图3c-d);同时,柠檬酸、琥珀酸和苹果酸水平显著增加(图3e)。因此,积累的乳酸和丙酮酸可能被重新导向了TCA循环以进行氧化磷酸化(OXPHOS)。值得注意的是,Mct1缺陷B细胞中的基础耗氧率(OCR)显著增加(图3f),但ATP水平仍与对照组相似(图3g)。结合细胞增殖和凋亡情况,可知MCT1转运蛋白并未影响B细胞的存活。
目前研究表明,线粒体融合有利于OXPHOS。当线粒体变化被检测时,在B细胞胞质中,Mb1Cre小鼠的线粒体呈小而圆的形态,而Mct1缺陷则呈管状分布(图3h)。进一步观测,缺陷型中还包含拉长的线粒体。此外,与线粒体融合一致,线粒体膜融合中介蛋白(Mfn1,Mfn2和Opa1)在Mct1缺陷B细胞中的mRNA和蛋白水平上均被上调(图3i)。
综上所述,MCT1的缺失最初导致乳酸在B细胞胞质中过量积累,这随后抑制了糖酵解,并促使乳酸重新转化为丙酮酸;然后,这些丙酮酸被重新导向线粒体丙酮酸氧化,最终导致代谢通路从糖酵解转向线粒体丙酮酸氧化。这种代谢通路的重编程使得Mct1缺陷B细胞能够维持能量稳态,这对于它们的存活和功能至关重要(图3j)。
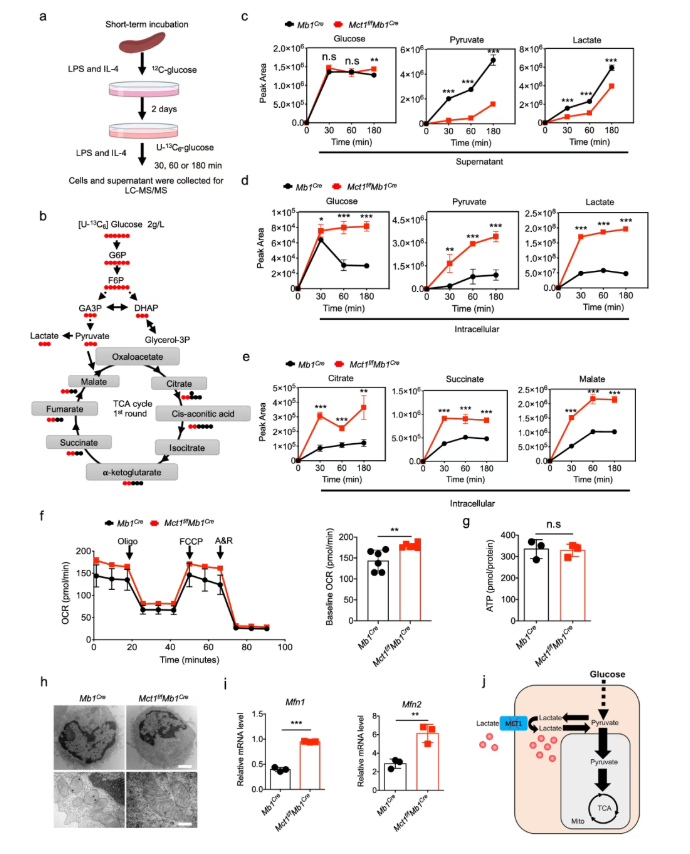
图3. Mct1缺陷促进葡萄糖流入线粒体丙酮酸氧化
4、丙酮酸与MCT1转运蛋白在功能上偶联以调节AID的表达
AID在CSR中起着至关重要的作用。对比Mb1Cre小鼠和Mct1f/fMb1Cre小鼠,在Mct1缺陷的B细胞中,其AID的表达显著降低(图4a);同样地,在mRNA和蛋白水平上,AID也出现剧烈下调(图4b-c)。由此推测,丙酮酸和乳酸,这两个MCT1转运蛋白底物可能在确保CSR效率方面发挥着相互作用。
为了明确乳酸和丙酮酸的作用,对Mb1Cre小鼠B细胞(对照B细胞)补充外源性丙酮酸或乳酸。结果表明,添加丙酮酸可以增加IgG1+B细胞的比例(图4d),而添加乳酸并未影响该比例。此外,在没有葡萄糖的情况下,向对照B细胞添加丙酮酸会增加AID的水平(图4e)。然而,在Mct1缺陷的条件下,外源性丙酮酸无法上调IgG1+B细胞的比例(图4f)。
为了评估丙酮酸在进入胞质后的作用,能够绕过MCT1转运的丙酮酸类似物——甲基丙酮酸(MePyr)被用于后续实验。结果显示,补充MePyr显著增加了IgG1+B细胞的比例(图4g)。此外,在没有葡萄糖的情况下,MePyr处理显著增强了Mct1缺陷B细胞中AID的表达(图4h)。
为进一步验证丙酮酸对CSR的影响,Mct1缺陷的A20-sgMct1系被构建(图4i)。在无葡萄糖条件下,丙酮酸以剂量依赖性的方式上调了野生型对照A20细胞中的AID表达,而MePyr上调了A20-sgMct1细胞中的AID表达(图4j-k)。
综上所述,在B细胞的CSR过程中,丙酮酸是确保AID表达的一个关键因素。
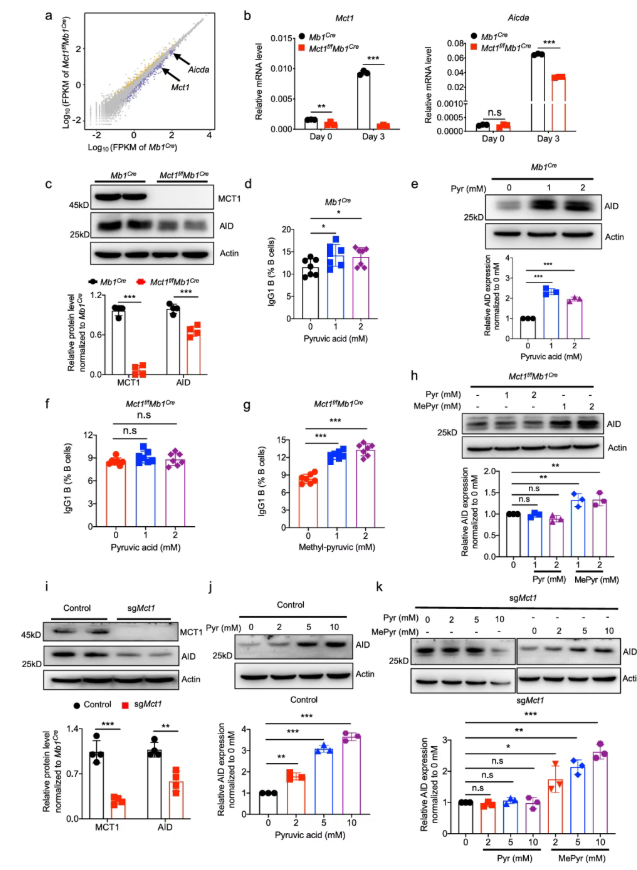
图4. 丙酮酸通过保护AID的表达来支持CSR
5、MCT1在CSR B细胞中维持Aicda基因启动子区域的染色质可及性
为了探究MCT1介导CSR的作用机制,Mb1Cre和Mct1f/fMb1Cre小鼠B细胞在LPS和IL-4处理下的全局转录动力学被解析。结果表明,在Mct1缺陷的B细胞中,H3K9、H3K14和H3K27的乙酰化水平均降低,而H3K18乙酰化和H3K27三甲基化基本未变(图5a)。进一步分析,受影响最严重的位点H3K27,其乙酰化可能通过组蛋白乙酰转移酶(CBP或P300)和组蛋白去乙酰化酶(HDAC或SIRT)来调控(图5b)。
为通过H3K27乙酰化探究MCT1介导的CSR潜在机制,其全基因组情况被分析。结果显示,Mct1缺陷导致Aicda位点的可及性显著降低(图5c),同时Aicda启动子区域的H3K27Ac信号也显著减少(图5d)。因此,MCT1转运蛋白可能通过确保H3K27的乙酰化来促进AID的表达。
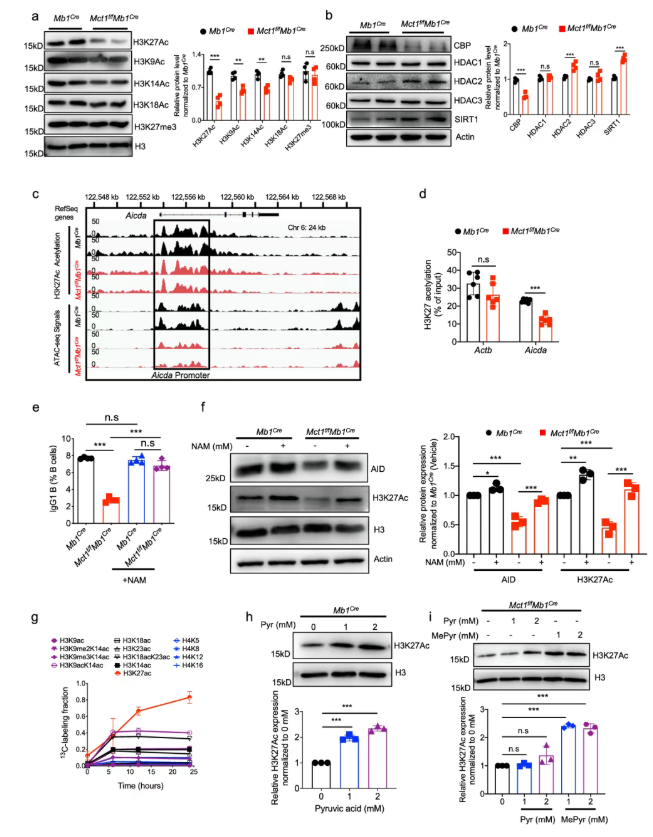
图5. MCT1通过葡萄糖代谢支持CSR,为组蛋白乙酰化提供底物
6、丙酮酸促进B细胞中组蛋白H3K27乙酰化
与对照B细胞相比,Mct1缺陷型的HDAC2表达上调;同时,CBP的表达减少,而SIRT1的表达增加(图5b)。当NAM(一种SIRT抑制剂)被应用时,其挽救了Mct1缺陷型中IgG+B细胞比例和AID表达的下降(图 5e-f),再次证实组蛋白乙酰化在B细胞CSR中发挥关键作用。结合定量蛋白质组学分析,丙酮酸直接参与了组蛋白H3K27的乙酰化过程(图 5g)。
为了评估丙酮酸的具体贡献,将Mb1Cre小鼠B细胞在含有丙酮酸的培养基中与LPS和IL-4共同培养。结果发现,丙酮酸的添加显著上调了H3K27Ac水平(图5h)。相比之下,外源性丙酮酸未能增加H3K27Ac水平,只有补充MePyr后,其水平才得以恢复(图5i),这与前文结果一致。
综上,MCT1转运蛋白通过维持细胞内高浓度的丙酮酸,促进H3K27的充分乙酰化,从而确保Aicda基因的最佳转录。
7、MCT1在SLE患者B细胞中高表达,有望成为SLE治疗的潜在靶点
系统性红斑狼疮(SLE)是一种自身免疫病,与B细胞的异常增殖有关。当包含SLE患者和健康对照不同B细胞亚群的GEO数据库(GSE118254)被分析时,发现SLE患者中IgG类别转换记忆B细胞和活化初始B细胞的MCT1表达显著高于健康对照(图6a)。此外,在两个包含混合B细胞亚群的GEO数据库(GSE10325和GSE4588)中,SLE患者B细胞中的MCT1表达也显著高于健康对照(图6b)。同样地,在研究者自建的临床队列,SLE患者的外周血单个核细胞在mRNA水平上也表现出MCT1表达显著增加(图6c)。
为验证上述临床队列分析结果,bm12诱导的狼疮小鼠模型被构建。结果显示,野生型(Mb1Cre小鼠)的脾脏显著大于Mct1缺陷型(Mct1f/fMb1Cre小鼠)(图6e)。相应地,Mct1缺陷型小鼠的GCBC和IgG1 B细胞比例显著减少(图6f-g),针对dsDNA的IgG抗体水平也显著降低(图6h)。此外,Mct1缺陷还缓解了Mct1f/fMb1Cre小鼠的肾炎,这很可能是由于肾小球中IgG自身抗体的积累减少所致(图6i-j)。当使用CHC(MCT1抑制剂)治疗时,其抗dsDNA抗体水平显著降低(图6k-l)。
综上,MCT1在SLE潜在的发病机制和治疗中的作用得到证实。
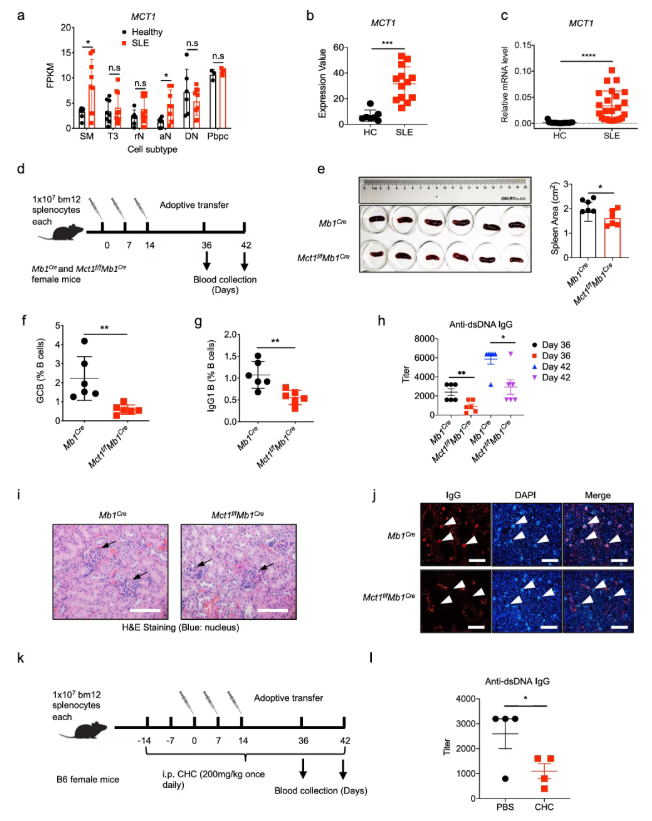
图6. 在bm12诱导的小鼠狼疮模型中,B细胞MCT1缺陷抑制IgG自身抗体的产生和GC的形成
研究小结
本研究揭示了MCT1通过调控丙酮酸代谢维持H3K27乙酰化水平,从而驱动AID表达及抗体CSR的分子机制。值得注意的是,SLE患者B细胞中MCT1表达显著上调,而Mct1缺陷可有效缓解bm12诱导的小鼠狼疮模型症状。这些发现不仅阐明了B细胞代谢重编程与表观遗传调控之间的功能偶联,更为疫苗开发和SLE治疗提供了潜在靶点。此外,研究首次建立了MCT1介导的丙酮酸代谢-H3K27乙酰化-AID转录轴在体液免疫应答中的核心地位,为代谢干预治疗自身免疫疾病提供了理论依据。
百趣生物靶标代谢流:基于稳定同位素示踪技术,聚焦糖酵解、TCA循环、PPP途径等关键代谢通路,可精准分析代谢物动态流量变化,实现代谢物高覆盖、高精准定量,助力揭示代谢通路活性、验证代谢调控机制,为生命科学研究及临床转化提供可靠数据支撑。