
文章标题:Development of a high-efficiency N-acetylneuraminic acid production platform through multi-pathway synergistic engineering
发表期刊:Trends in Biotechnology
影响因子:14.9
客户单位:南开大学
百趣提供服务:新一代代谢组学NGM、靶标代谢流
研究概览
研究团队通过基因工程改造大肠杆菌,从而实现对葡萄糖和甘油的高效共利用。研究团队对两条起点与终点相同的合成途径进行重构,以提高N-乙酰甘露糖胺(ManNAc)前体的水平;同时,利用人工智能(AI)技术和机器学习(ML)序列挖掘方法对N-乙酰神经氨酸(NeuAc)合酶进行优化。随后,通过捕获竞争再生途径中的碳流来提高磷酸烯醇式丙酮酸(PEP)的水平,从而平衡胞内PEP与ManNAc的比例,以促进NeuAc的合成。除葡萄糖外,还研究开通了甘油这一额外碳源输入途径,在补料分批发酵中实现了70.4 g/l的NeuAc滴度,生产率为1.17 g/l/h。该研究构建了用于NeuAc生物合成的高效微生物细胞工厂,并提供了一种可应用于其他高价值化合物生产的通用系统工程策略。
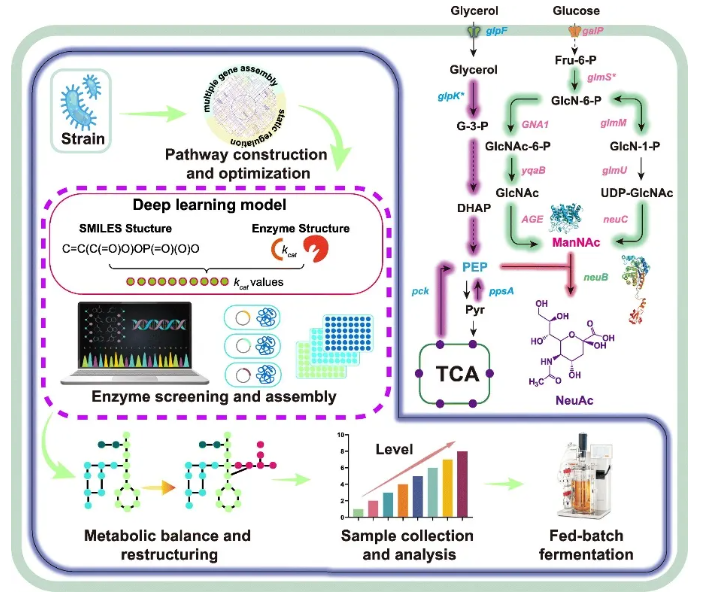
研究结果
1.构建双途径用于ManNAc从头的生物合成:解决前体供给不足问题
NeuAc生物合成的直接前体是ManNAc,在大肠杆菌中合成ManNAc主要遵循两种途径:N-乙酰氨基葡萄糖2-差向异构酶(N-acetylglucosamine 2-epimerase, AGE)途径和N-乙酰神经氨酸合酶(UDP-N-acetylglucosamine 2-epimerase, NeuC)途径,这两种途径均源自果糖-6-磷酸(Fru-6-P),见图1。
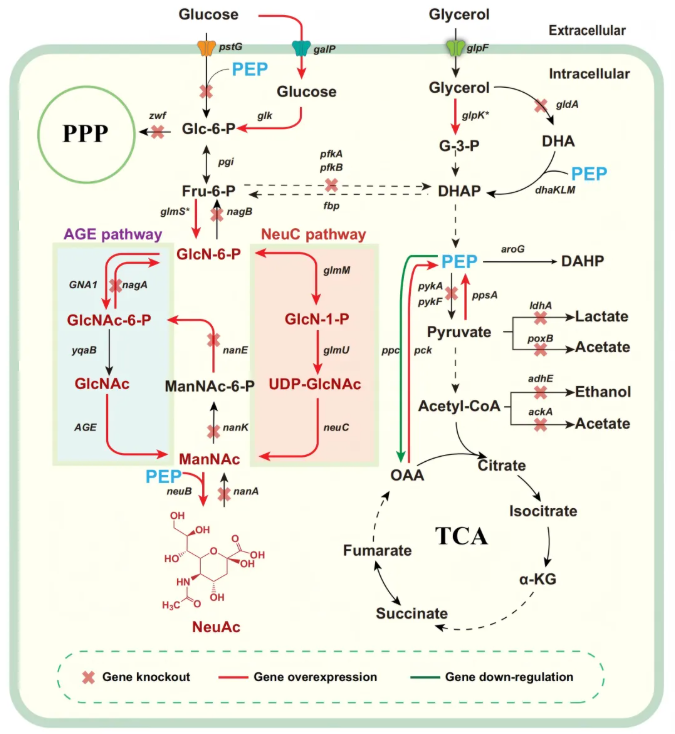
图1. 大肠杆菌中NeuAc完整合成途径
AGE途径是研究重点优化的外源途径,核心是通过引入关键酶并阻断副产物消耗,实现GlcNAc向ManNAc的定向转化。研究人员首先克隆酿酒酵母来源的葡萄糖-6-磷酸乙酰转移酶(GNA1)基因,构建初始质粒pACYC-M46-GNA1,实现AGE途径关键第一步的搭建。之后敲除底盘菌株中参与副产物形成(ldhA、adhE、ackA、poxB)和目标产物降解的关键基因(nanATEK、nagAB),从而减少碳流浪费、提升前体积累,同时在nagAB基因位点整合反馈抑制抗性突变体glmS*,解除代谢瓶颈,显著提升GlcNAc产量(8.81 g/l)(图2B)。
GNA1作为AGE途径的起点,研究人员试图通过微调GNA1表达来增强GlcNAc的产生。首先选取M12、M30、M37、M46、M64五种人工调控元件(Artificial Regulatory Part, ARPs),克隆到含p15A复制起点的质粒上,以RFP相对荧光强度确定其表达强度梯度,结果显示M37最强、M12最弱,M30、M46、M64处于中等水平(图2C)。再用一步克隆试剂盒将低、中、高强度的(M12、M46、M37)ARPs,分别克隆pACYCDuet1、pCDFDuet-1、pETDuet-1、pRSFDuet-1四种不同复制起点/拷贝数的质粒上,构建12种具不同表达能力的质粒(图2D),随后将这些质粒导入BL21 ∆nagAB::glmS*菌株,获得BA1–BA12工程菌株,经实验筛选出采用中强度ARPs M46与中等拷贝质粒 pCDF组合的BA5菌株,其GlcNAc产量达到峰值10.95 g/L,明确将GNA1表达调控至适度水平对优化GlcNAc合成的重要性。实验过程中以24、48、72和96h的时间间隔收集GlcNAc标准品和工程菌发酵收获的样品,采用高效液相色谱法(HPLC)进行分析(图2E)。
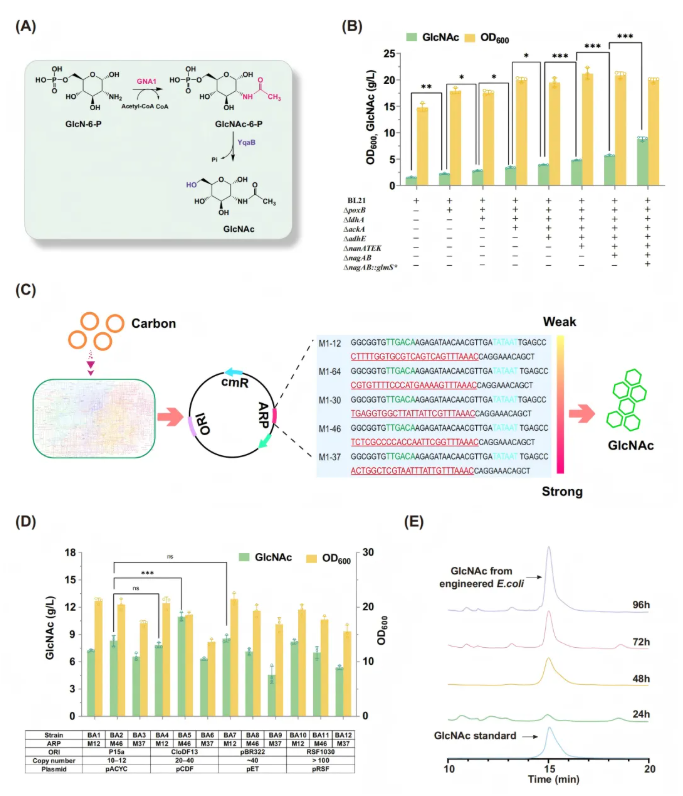
图2. 优化GNA1表达提升GlcNAc产量
鉴于具有增强活性和效率的新型AGE酶对于增加ManNAc生物合成至关重要,研究人员通过NCBI BLAST筛选70个不同属的AGE酶候选序列,使用具有代表性的同源物,对候选酶进行了系统发育分析,从而创建了一个数据集,其中包含均匀分布在16个独立集群中的AGE变体(图3B)。随后,研究人员将待表征酶的异构SMILES结构及其前体引入深度学习模型Uni-KP,计算出各候选AGE的预测催化常数,从而筛选出犬咬二氧化碳嗜纤维菌(Capnocytophaga canimorsus)来源的CapAGE活性最高(图3C)。为了进一步评价这些AGEs在大肠杆菌中生产ManNAc的性能,在GlcNAc高产菌株BA5中验证了前10个转化效率较高的候选AGEs。对构建的菌株进行培养,测定ManNAc和GlcNAc的滴度。与预筛选结果一致,C. canimorsus过表达CapAGE获得的ManNAc滴度最高,为3.5 g/l(图3D)。
为进一步提升CapAGE效率,将其置于人工调控元件(ARPs)控制下导入BA5菌株,并针对已携带GNA1的质粒,调整CapAGE前的组成型ARPs强度。结果发现,CapAGE表达对ManNAc合成影响较小,但会适度影响GlcNAc积累(图3E);而当GNA1与CapAGE均由中强度ARPs(M46)调控、且共置于中等拷贝质粒pCDF(CloDF13复制子)时,菌株实现最优生长与产物合成,GlcNAc产量达10.19 g/L、ManNAc达3.74 g/L。
除了AGE途径外,GlcN-6-P还可以用于各种细胞多糖的生物合成。为了将这部分碳通量引导到NeuAc的产生,研究人员构建NeuC途径。将大肠杆菌K1来源的NeuC与内源关键酶GlmM、GlmU随机组装至含高强度ARPs(M37)的质粒pACYC,导入BL21 ∆nagAB::glmS*菌株后发现,按“glmM-glmU-neuC”顺序排列的菌株ManNAc产量最高,达1.2 g/L, 是NeuC途径的最优基因排列顺序。
然后将NeuC通路与AGE通路一起引入底盘菌株BAM5中,以促进ManNAc的产生。经过测试实验表明,携带质粒pCDF-M46-GNA1-CapAGE和pRSF-M12-glmMU-neuC的菌株BAC10获得了最高的ManNAc滴度达5.3 g/l(图3G)。
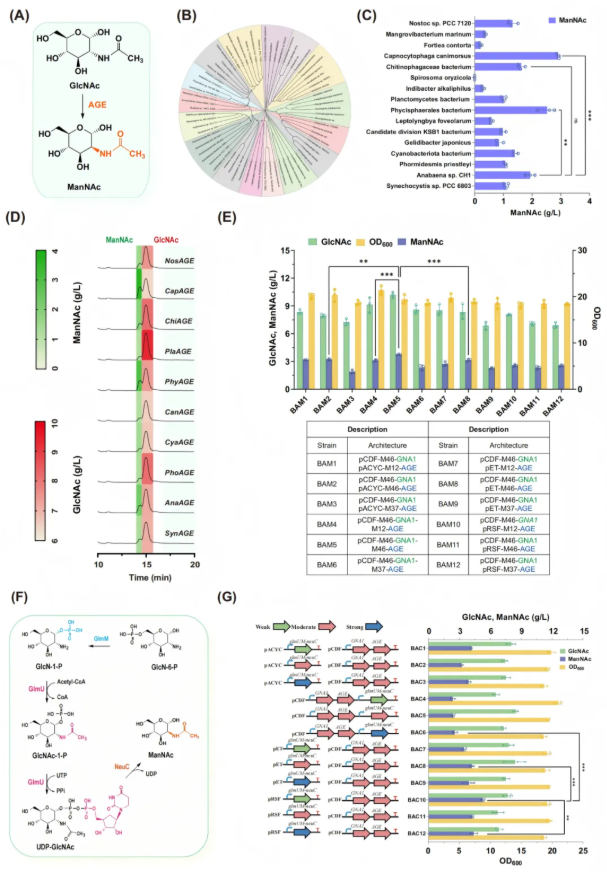
图3. 构建AGE和NeuC双途径促进ManNAc的生成
2.NeuAc合酶(NeuB)的挖掘与优化:突破终端限速步骤
与AGE途径的优化流程类似,研究人员将脑膜炎奈瑟菌MC58来源的NmNeuB单独插入含中拷贝数与中强度组成型人工调控元件(ARP)的pET-M46质粒,再将该质粒转化至高效提供ManNAc前体的大肠杆菌底盘菌株BAC10,得到菌株BAC10-NmneuB。经LC-MS/MS验证(图4B),该菌株可成功合成NeuAc,而对照菌株无NeuAc产生,证实NmNeuB具备NeuAc生物合成功能。批次发酵结果显示,大肠杆菌BAC10-NmneuB菌株的NeuAc产量达3.45 g/L(图4E)。
由于NeuB在NeuAc生物合成的终端步骤至关重要,为优化其催化效率,通过NCBI BLAST搜索,从众多候选酶中筛选出109个NeuB候选酶,并使用综合系统发育树阐明了它们的系统发育关系(图4C)。经高通量预测(基于Uni-KP模型计算kcat值)和实验评估,发现4种新的NeuB酶性能优于常用的NmNeuB,其中来自Idiomarina sp. Sol25的IrNeuB活性最高(图4D)。将筛选出的10种催化活性较高的候选酶分别克隆到pET-M46质粒中并转化到高产菌株BAC10中,发酵后经HPLC分析,结果显示所有NeuB酶都能利用ManNAc产生NeuAc,其中IrNeuB产生的NeuAc浓度最高,达5.55 g/L(图4E),这也与预筛选结果保持一致。进一步对表达IrneuB的菌株进行优化,发现低拷贝数和中等强度组成型ARP的组合可使NeuAc产量最高,达6.51 g/L。尽管通过调节关键酶NeuB提高了NeuAc产量,但培养物中GlcNAc和ManNAc的存在表明进一步的代谢瓶颈仍有待解决(图4F)。
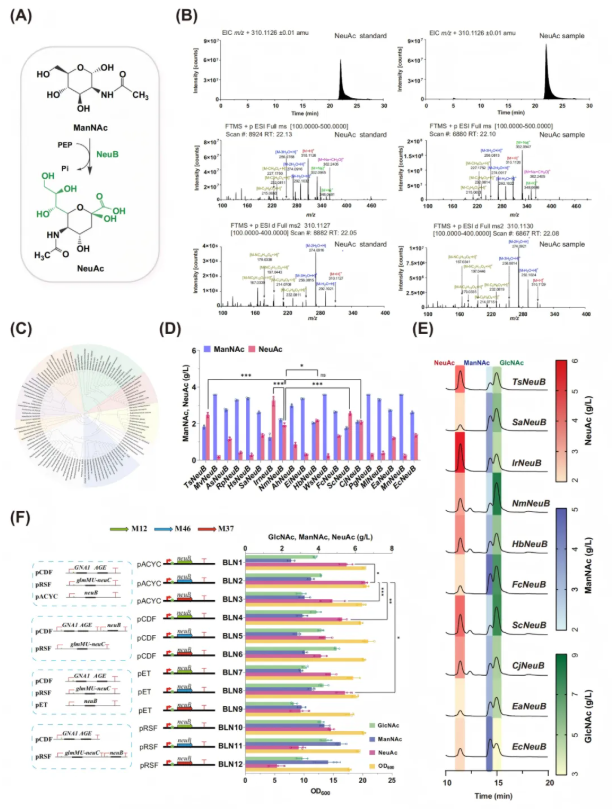
图4. NeuB的筛选与优化
3.通过PEP回收和捕获策略增强NeuAc合成
研究发现PEP作为NeuAc的基本前体,其可用性是NeuAc生产的关键瓶颈。在BLN2菌株中,细胞内PEP水平比ManNAc低5.73倍 ,可能存在碳代谢通量不平衡,限制了NeuAc的合成(图5A)。为解决这一问题,研究人员通过PEP循环与捕获策略强化NeuAc合成:一方面,阻断PEP消耗(敲除pykA)、优化葡萄糖摄取系统(敲除ptsG并过表达galP与glk)、弱化PEP竞争途径(用GUG替换ppc起始密码子),减少PEP非目标流失(图5B);另一方面,强化PEP再生(过表达pck与ppsA),提升PEP合成效率。经系列改造,菌株NeuAc产量从初始6.51 g/L逐步提升至11.8 g/L(图5C),较原始菌株提升约81%,成功平衡胞内前体比例,突破PEP供给不足的瓶颈,为后续NeuAc高效生产奠定基础。
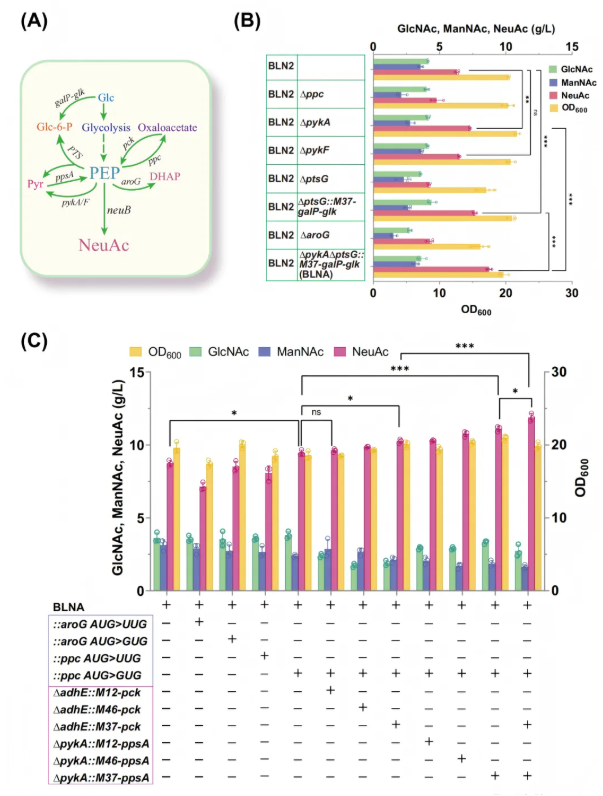
图5. 加强PEP供应对NeuAc生产的影响
4.通过引入新的碳源建立协同碳利用体系
在大肠杆菌中,葡萄糖代谢主要通过糖酵解和磷酸戊糖途径(PPP)发生,这两者都会产生中间代谢物和能量来支持细胞生长。为解决单一葡萄糖碳源在NeuAc合成中的碳流冲突问题,研究人员通过引入甘油作为新碳源,构建 “葡萄糖-甘油” 双碳源协同利用系统。实施中,首先将先前表征的突变甘油激酶基因(glpK*)插入菌株BLNAC的poxB位点,产生菌株BLNK,其甘油代谢改善,NeuAc产量达13.5 g/L。然后敲除pfkA、zwf、gldA等冗余碳流途径基因,减少碳源无效流失,提高NeuAc产量,最终构建菌株BLNK-5,其NeuAc产量达到16.4 g/L,且残留的GlcNAc和ManNAc水平降低(图6A)。
在不同碳源条件下培养构建的菌株,评估其代谢行为,并对BLNK-5和亲本菌株BLN2进行非靶代谢组学分析和13C-葡萄糖示踪。结果表明,BLNK-5中与葡萄糖代谢相关的中间产物(如Glc-6-P和Fru-6-P)水平下降,甘油衍生的G-3-P增加,NeuAc前体显著增加(图6B),且约46%的NeuAc碳源自葡萄糖,其余来自甘油,证实甘油可有效补充PEP,维持碳通量稳定(图6C)。最后筛选出葡萄糖-甘油1:2的最优比例(图6D),此时碳流分配合理,甘油补充ManNAc合成碳骨架,葡萄糖优先供给PEP再生,菌株NeuAc产量可达18.6 g/L。
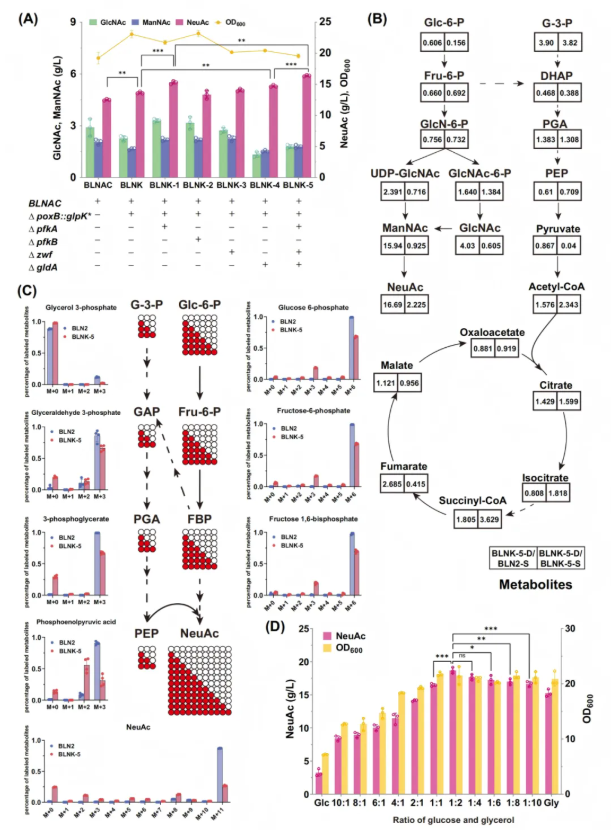
图6. 建立平行甘油-葡萄糖共利用途径以高效合成NeuAc
5.在5L发酵罐中高水平生产NeuAc
这部分是研究人员将NeuAc合成从摇瓶小试推向中试规模的关键环节,以经双碳源优化的菌株BLNK-5为出发菌株,在5L生物反应器中采用分批补料发酵策略(图7C)。通过分阶段调控温度(前期37℃促菌体生长,当光密度(OD)达到17时降至30℃)、按1:2比例流加葡萄糖-甘油混合碳源以稳定碳源浓度,最终实现70.4 g/L的NeuAc产量,生产效率达1.17 g/l/h,且检测液中几乎没有GlcNAc、ManNAc(图7A),验证了前期途径优化与工艺参数在中试规模的适配性,为NeuAc工业化生产提供了核心数据支撑。
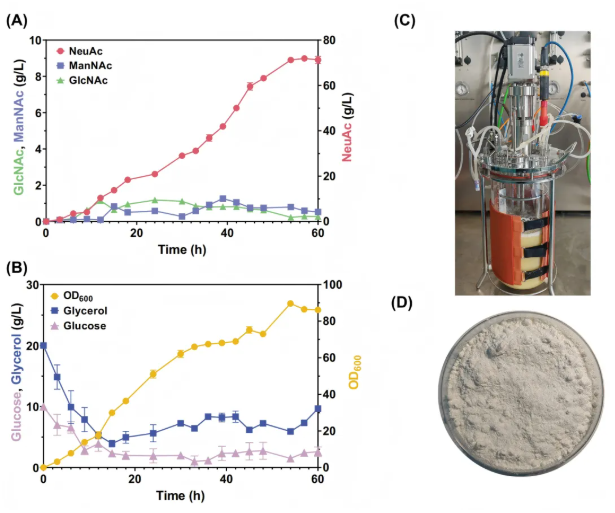
图8. 工程菌株BLNK-5在5L发酵罐中生产NeuAc
研究结论
本研究以大肠杆菌为底盘菌株,聚焦NeuAc的高效生物合成,通过多途径协同工程策略,显著提升NeuAc生产的经济可行性,实现70.4 g/l的显著生产性能。该研究使用的技术手段包括人工智能驱动的酶挖掘和系统测试的简化工作流程,合理的目标识别和微调,来自共享代谢节点的多种前体的平衡调节,以及跨不同水平的组合优化策略。这种系统的代谢工程框架在克服其他生物制造细胞工厂面临的挑战方面也具有巨大的潜力。
新一代代谢组学NGM 3:聚焦代谢组学检测的准确度和可靠性,依托 20000+代谢物标准品自建库,搭载Orbitrap Astral质谱仪,以严格四核算法、自动化前处理及全流程质控,全面提升检测结果准确性。另外NGM 3借助MetDNA3代谢网络数据库,还能发现此前未被发现的暗物质,帮助突破科研瓶颈。
靶标代谢流:基于稳定同位素示踪技术,聚焦糖酵解、TCA循环、PPP途径等关键代谢通路,可精准分析代谢物动态流量变化,实现代谢物高覆盖、高精准定量,助力揭示代谢通路活性、验证代谢调控机制,为生命科学研究及临床转化提供可靠数据支撑。