
文章标题:Integrative multi-omics reveals that Salvia miltiorrhiza active fraction ameliorates rheumatoid arthritis in rats via inhibiting inflammation and ferroptosis
发表期刊:Phytomedicine
影响因子:8.3
研究背景
类风湿关节炎(Rheumatoid Arthritis, RA)是慢性高致残性自身免疫病,需终身管理,现有疗法长期毒性大、费用高。丹参因活血化瘀、抗炎功效临床用于RA治疗,但其RA治疗的特定活性部位及潜在机制尚不明确。近期,广东省新药设计与评价重点实验室金晶教授在Phytomedicine期刊发表题为“Integrative multi-omics reveals that Salvia miltiorrhiza active fraction ameliorates rheumatoid arthritis in rats via inhibiting inflammation and ferroptosis”的研究。该研究以整合多组学技术探索丹参活性部位抗RA的作用及机制,发现丹参乙酸乙酯提取物(ET)可通过调节炎症、铁死亡、氨基酸代谢及滑膜细胞失调改善RA病理,展现出显著治疗潜力。
研究概览
研究结果
1. 丹参活性部位的筛选与表征
既往证实丹参酮类可治RA,提取物可提升其生物利用度。研究以丹参干燥根为原料,经提取纯化分离得到4个活性部位:乙醇提取部位(YC)、乙酸乙酯提取部位(ET)、总丹参酮部位(T-Tan)、乙酸乙酯洗脱部位(ZCX)。
以小鼠巨噬细胞RAW264.7筛选抗炎效果:RT-qPCR显示,YC、ET、T-Tan均抑制Tnf-α、Il-1β、Il-6的mRNA表达,且ET、T-Tan效果更优(图1A-C);NO释放实验中,仅ET、T-Tan有效抑制NO释放(图1D)。药代动力学实验显示,ET可显著提高血浆隐丹参酮(CTS)浓度(图1E-G),故确定ET为核心活性部位。经UHPLC-Q Exactive-MS与HPLC分析,明确ET含5种主要化合物(图1H-J),结合现有研究推测其还含丹参醇A、丹参酮甲酯、迷迭香酸等。
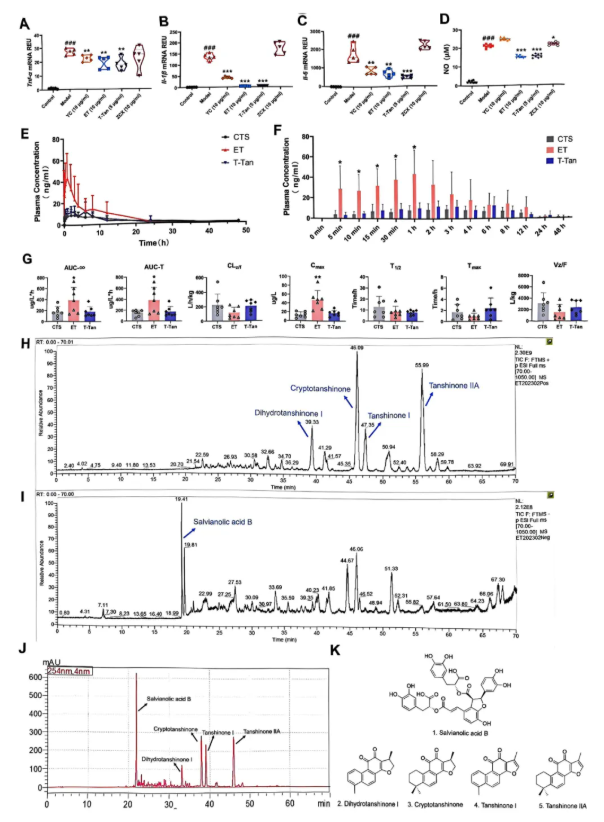
图1. 丹参有效活性位点的筛选及提取物成分分析
2. ET可抑制胶原诱导关节炎(CIA)大鼠疾病进展并改善病理
研究通过CIA建立Sprague–Dawley大鼠RA模型,评估ET药效:各组大鼠体重稳步上升、生存状态良好(图2A);与模型组相比,ET组及阳性药甲氨蝶呤(MTX)组大鼠关节肿胀减轻、足部病变减少(图2B-E);Micro-CT显示,ET显著改善CIA模型组踝关节模糊、骨侵蚀、间隙变窄(图2F);H&E染色显示 ,ET减少关节内炎症细胞浸润、改善骨软骨损伤(图2G);TRAP染色显示, ET减少破骨细胞生成,阻止骨侵蚀(图2H);ELISA检测显示,ET逆转CIA诱导的血清TNF-α、IL-1β、IL-6、IL-17a高表达,同时降低踝关节中相关因子的mRNA及蛋白水平(图2I-L)。综上,ET可延缓RA进展、减轻炎症并改善病理。
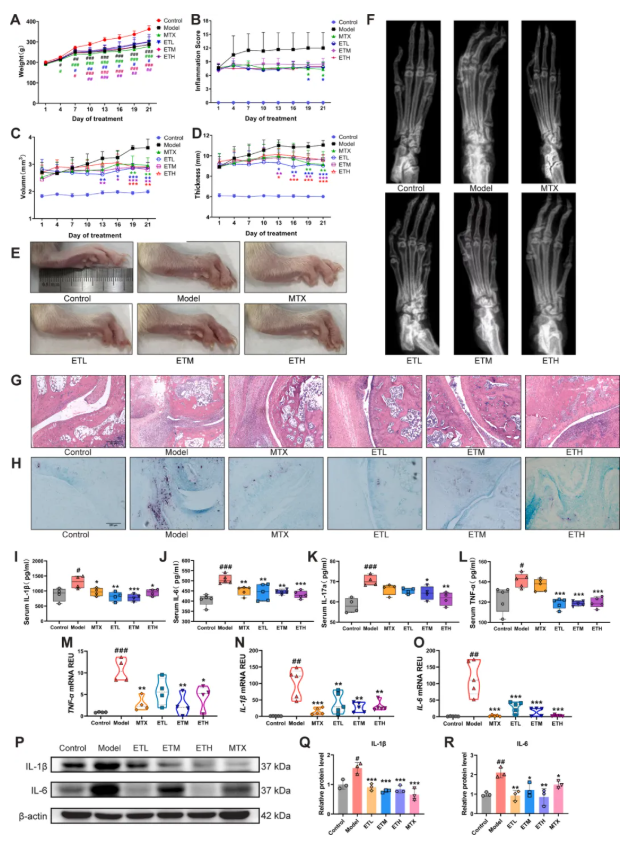
图2. 丹参ET有效抑制RA大鼠疾病进展,改善病理及生理状况
3. ET改变CIA大鼠的血清代谢组
为明确ET对RA大鼠血清代谢物的调控作用,该研究分析对照组、模型组及ET低剂量组(ETL)大鼠血清代谢物。PCA显示,三组代谢物差异显著(图3A-B);OPLS-DA显示,模型组与给药组代谢谱差异显著(图3C-D);差异代谢物热图显示,模型组与正常组代谢物差异极显著,ET处理后代谢物向正常组恢复(图3G);正离子模式下48种代谢物显著上调、209种显著下调;负离子模式下4种显著上调、63种显著下调(图3H-I);富集分析显示, ET主要影响溶质载体(SLC)蛋白介导的转运通路(图3J);通路分析显示, ET主要调控氨基酸代谢通路(图3K)。综上,ET可通过调控RA大鼠氨基酸代谢,使其代谢谱接近正常,缓解RA病理。
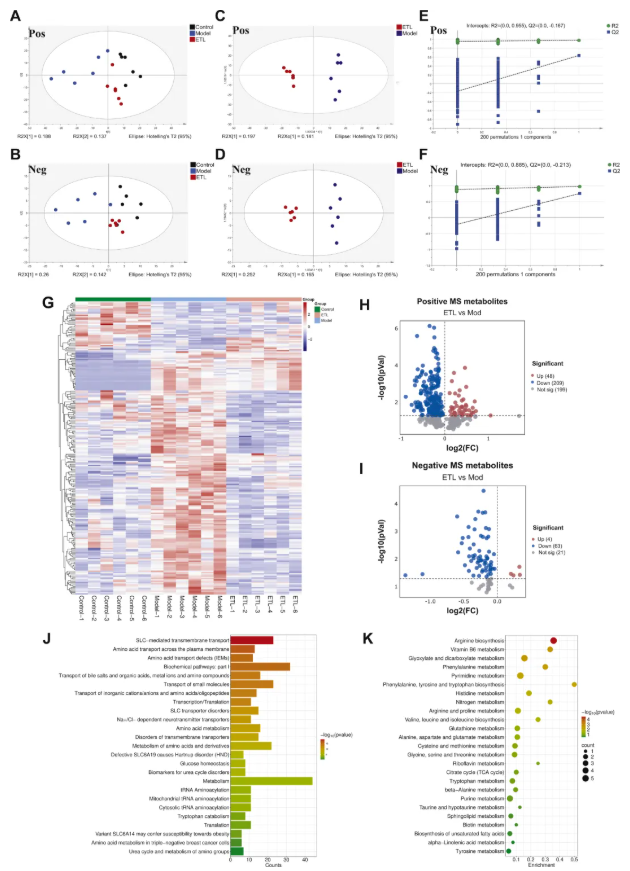
图3. RA大鼠血清的非靶标代谢组学分析
4. ET调控巨噬细胞代谢组
通过非靶标代谢组学分析ET对脂多糖(LPS)诱导的RAW264.7细胞代谢物的影响:PCA显示,对照组、模型组、ET处理组区分明显(图4A-B);OPLS-DA显示,模型组与ET处理组差异显著(图4C-D)。差异代谢物热图显示,LPS刺激后巨噬细胞代谢物显著变化,ET处理后部分代谢物向正常组恢复(图4G)。正离子模式下108种代谢物显著上调、34种显著下调;负离子模式下37种显著上调、25种显著下调(图4H-I)。
研究还发现,ET对细胞代谢物与大鼠血清代谢物的影响相似,均可能通过调控转运蛋白干预氨基酸代谢(图4J-K)。总之,RA病程中巨噬细胞变化对疾病状态起关键作用,探究ET对巨噬细胞的作用机制,对理解其体内疗效意义重大。
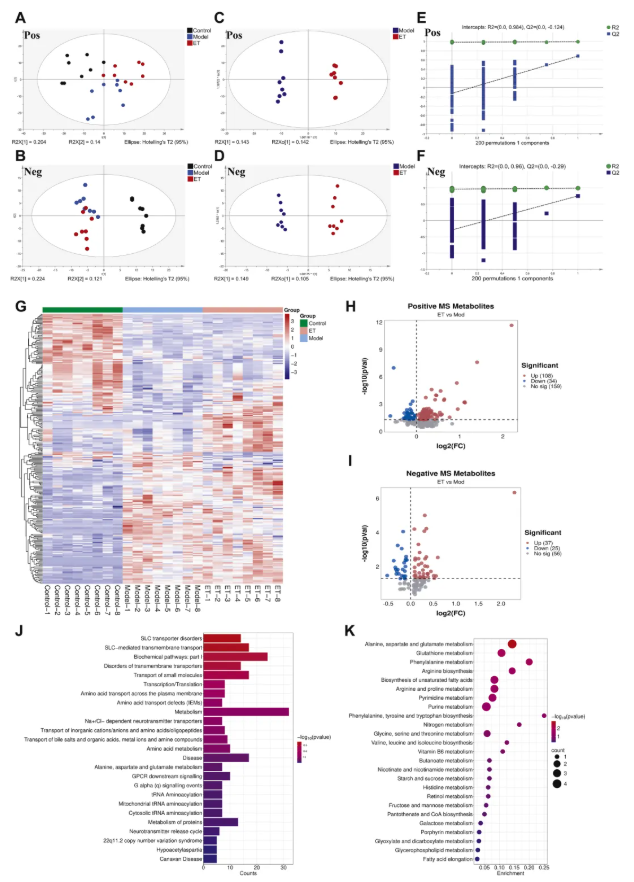
图4. ET对RAW264.7细胞非靶标代谢组学的影响
5. ET调控巨噬细胞炎症、铁死亡及氨基酸代谢相关基因表达
为明确ET引发的关键基因变化及通路关联,该研究对RAW264.7细胞开展转录组学研究:造模后2434个基因上调、1191个基因下调(图5A);与模型组相比,ET处理后186个基因上调、242个基因下调(图5B),热图显示细胞基因表达谱显著改变(图5C)。GO富集分析显示,生物过程层面,ET主要影响炎症、免疫应答通路,调控细胞铁离子稳态;细胞组分层面,变化集中在细胞内外环境,涉及生物膜及转铁蛋白受体复合物;分子功能层面,除细胞因子与趋化因子相关变化外,氨基酸、脂质及铁转运相关蛋白也有改变(图5D-F)。KEGG通路富集分析显示,ET除影响炎症和免疫相关通路外,还调控铁死亡、程序性坏死及部分氨基酸代谢通路(图5G-I),可从多维度调控RAW264.7细胞。
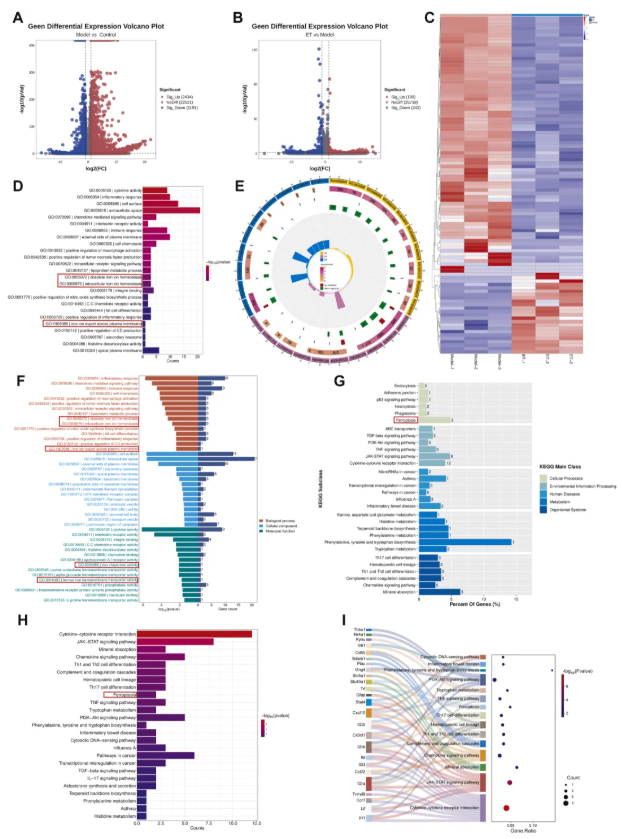
图5. 转录组学分析ET对RAW264.7细胞差异基因及通路的影响
6. ET调控巨噬细胞在炎症、铁死亡及氨基酸代谢中的蛋白表达
为全面解析ET作用机制,该研究还对RAW264.7细胞开展蛋白质组分析。热图显示,模型组与ET处理组的蛋白质组成差异显著(图6A);ET处理后163个蛋白质上调、184个蛋白质下调(图6B)。GO富集分析显示,生物过程层面,ET主要影响炎症与免疫应答相关蛋白质;细胞组分层面,变化集中在细胞器及细胞膜相关蛋白质;分子功能层面,涉及蛋白质结合、酶结合及金属结合相关蛋白质(图6C-D)。KEGG分析显示,差异蛋白质主要富集于代谢相关通路、铁死亡通路及细胞凋亡/坏死相关通路(图6E-G)。对前3个显著通路做蛋白质-蛋白质相互作用(PPI)分析,发现TNF-α、IL-1β、Hmox1为核心枢纽蛋白(图6H);结合多组学可见,ET显著调控铁死亡通路,且Hmox1变化最显著(图6I),此外铁死亡与炎症通路通过关键蛋白质密切关联(图6J),提示ET影响的通路存在相互调控。
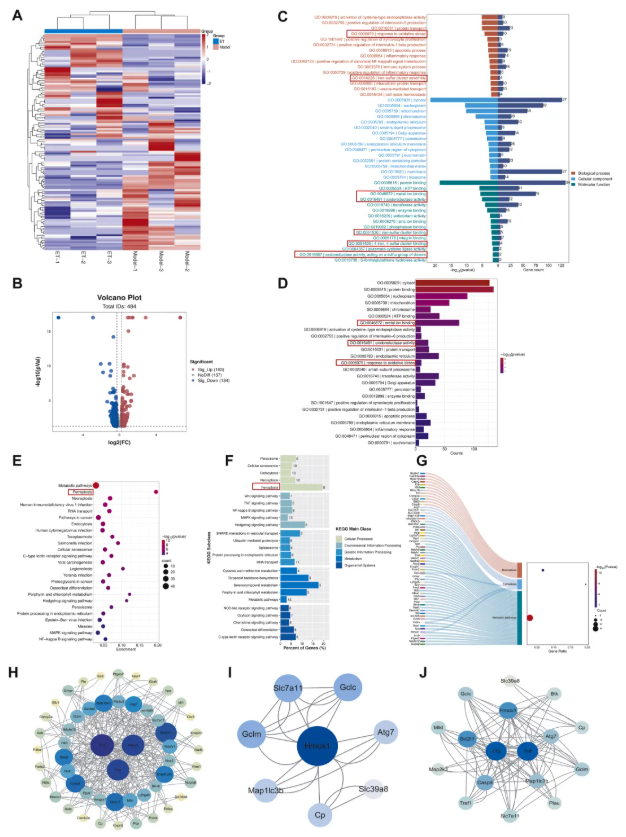
图6. 蛋白质组学分析ET对RAW264.7细胞差异蛋白及通路的影响
7. ET抑制巨噬细胞炎症因子释放并间接影响FLS的增殖与迁移
实验证实,ET显著降低巨噬细胞中诱导型一氧化氮合酶及IL-1β、IL-6、TNF-α的蛋白质表达(图7A-C)。采用巨噬细胞条件培养基培养滑膜成纤维细胞(FLS):划痕愈合实验显示, ET间接抑制FLS增殖与迁移(图7D-E);ET还间接下调增殖相关蛋白周期蛋白A2(CCNA2)表达,上调细胞周期蛋白依赖性激酶抑制剂1A(P21)、1B(P27)表达(图7F-G),并间接抑制FLS释放TNF-α、IL-1β、IL-6(图7H-J)。综上,ET可通过直接与间接作用多通路缓解RA症状。
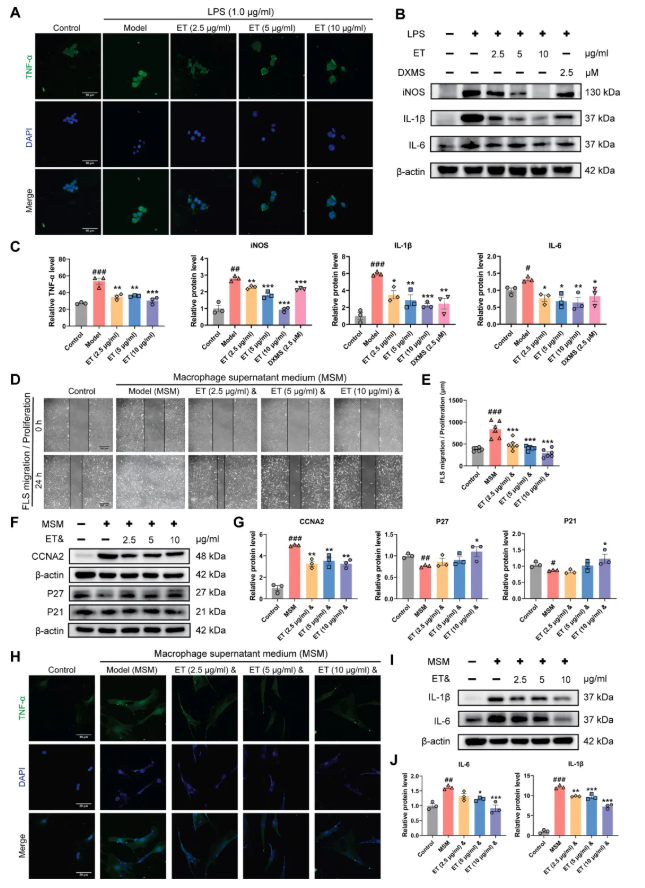
图7. ET抑制RAW264.7细胞炎症因子释放,间接抑制FLS活化
8. ET抑制RAW264.7细胞铁死亡
基于多组学结果,该研究进一步探究ET对RAW264.7细胞铁死亡的影响:LPS刺激后,细胞脂质过氧化显著,Fe²⁺、Lip-ROS等标志物水平升高(图8A-B);ET 处理可降低Fe²⁺、Lip-ROS及MDA水平(图8E)。在铁死亡关键蛋白方面,ET可降低4-HNE表达,显著上调Nrf2、Hmox1、SLC7A11、GPX4的蛋白表达,降低ACSL4、ALOX15蛋白水平,上调FTL、FTH表达(图8C-D)。综上,ET主要通过调控脂质过氧化和抗氧化信号通路抑制铁死亡。
进一步研究显示,铁死亡诱导剂RSL3处理细胞后,炎症因子表达显著升高;ET处理可显著抑制该炎症反应,提示铁死亡伴随炎症因子释放,抑制这些因子可调控铁死亡进展(图8F-H)。综上,ET通过多方面改善RA疾病状态,证实其多靶点作用机制,揭示通路交叉调控作用。
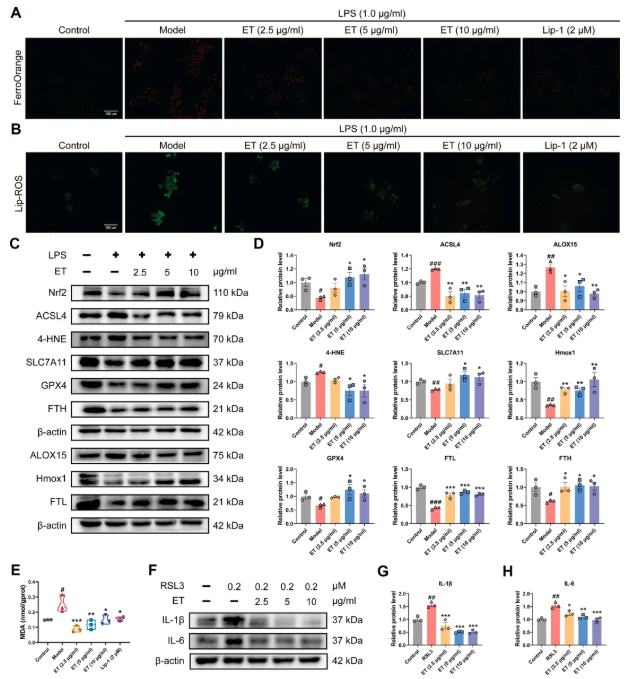
图8. ET可抑制RAW264.7细胞的铁死亡
9. ET中的主要化合物可抑制炎症并抵抗铁死亡的发生
研究探究了ET中5种主要化合物(SalB、DIH、CTS、TanI、TanIIA)的活性:检测显示,5种化合物均能抑制IL-1β、IL-6、iNOS的蛋白表达(图9A-D),同时抑制Il-1β、Il-6、Tnf-α的mRNA表达(图9E);在铁死亡调控方面,5种化合物均能不同程度抑制脂质过氧化,降低Fe²⁺、Lip-ROS水平(图9F-G),且能不同程度上调Nrf2、Hmox1、SLC7A11、GPX4的表达,降低ACSL4、ALOX15的表达,但对FTH、FTL的蛋白表达几乎无影响(图9H-J)。综上,ET的治疗效果是其多种化合物协同作用的结果,符合中医药“多成分、多通路协同治疗疾病”的理念。
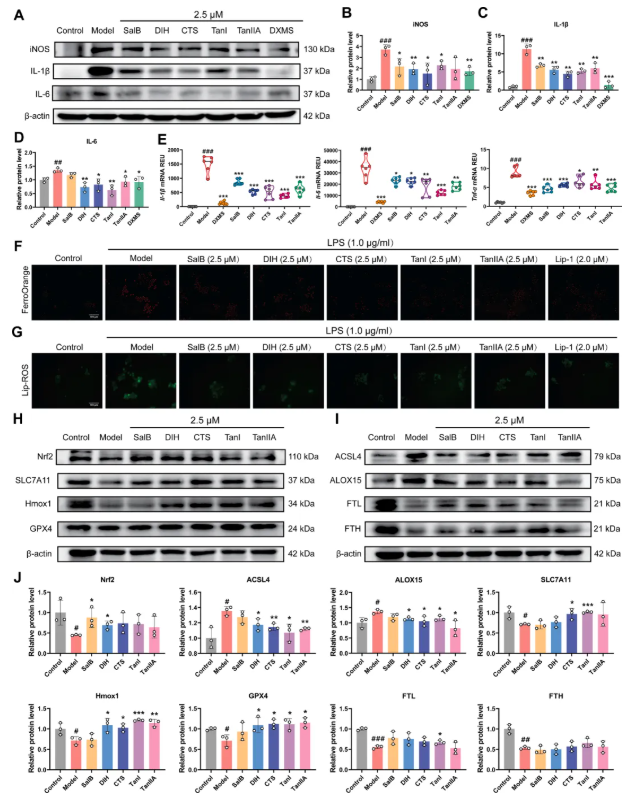
图9. ET中主要化合物调节RAW264.7细胞炎症与铁死亡
研究小结
研究团队经体内外筛选与成分分析,锁定丹参ET为抗RA核心活性组分。在CIA大鼠模型中,ET显著改善关节病理损伤、延缓疾病进展;多组学分析揭示其多靶点机制:抑制炎症、调控铁死亡、平衡氨基酸代谢,还通过调控巨噬细胞间接改善FLS异常增殖、迁移及纤维化(图10)。ET成本低、易获取,还解决单一成分口服生物利用度低的问题,治疗潜力显著,既印证中医药协同理念,也为RA治疗提供新方向。
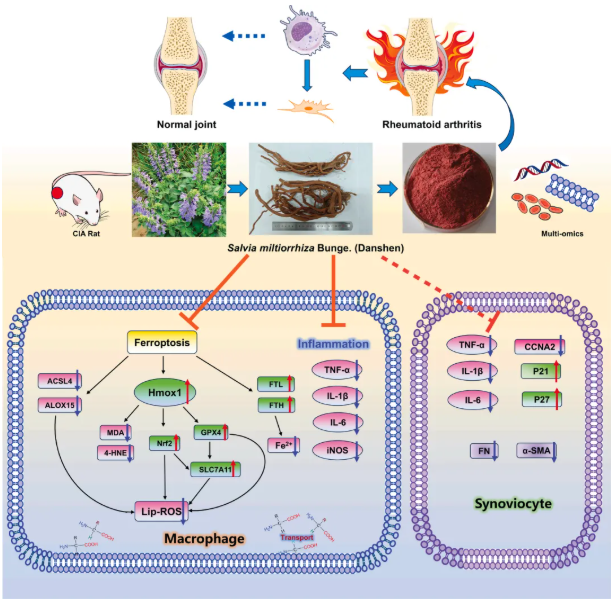
图10. ET通过调节炎症、铁死亡、氨基酸代谢及滑膜细胞失调改善RA病理
中药NGM 2:依托新一代代谢组学技术,聚焦中药成分准确鉴定核心需求。联合两大专业数据库,物质鉴定标准对齐国际顶级期刊(MSI),level 1鉴定准确率高达98%,检出物质数量500+。支持中药材、血清等多类样本,助力中药机制研究!