你以为蛋白质的功能调控是 “单打独斗”?其实,翻译后修饰(Post-Translational Modification,PTM)早已开启 “组团模式”—— 不同修饰间的 crosstalk(交叉调控),才是细胞精准响应信号、调控生命活动的核心密码!
那什么是修饰间的 crosstalk 呢?
简单说,就是同一蛋白质或蛋白复合物上,磷酸化、乙酰化、泛素化等不同修饰 “相互沟通、彼此影响”。
有的是 “互助队友”(协同增强调控效应),有的是 “制衡对手”(拮抗抑制彼此作用),更有的是 “接力选手”(级联触发下游信号)。这种 “组合调控” 让蛋白质功能调控从 “开关式”升级为 “精准编程式”,完美适配复杂生命需求。
修饰间的 crosstalk 大致主要分为以下三类:
1.同一蛋白质上不同修饰位点 crosstalk :例如某蛋白的磷酸化可能促进或抑制其乙酰化修饰,反之亦然;
2.不同蛋白质间的修饰关联:A 蛋白的泛素化可能影响 B 蛋白的磷酸化,形成级联调控;
3.修饰类型的组合效应:多种修饰共同作用时,可能产生单一修饰无法实现的功能(如增强蛋白质稳定性、改变亚细胞定位等)。
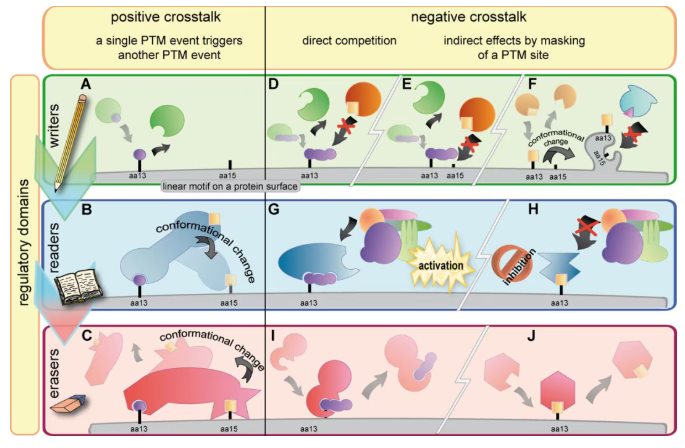
图1 修饰 crosstalk 分类
修饰间的 crosstalk 调控机制,已逐渐成为学术界的研究热点与前沿方向。单一修饰的研究早已无法解释复杂生理 / 病理机制,肿瘤细胞的异常增殖、神经退行性疾病的蛋白聚集、免疫细胞的活化调控等,背后往往是多种修饰 crosstalk 的紊乱。
接下来,让我们一起通过几篇文献加深对修饰 crosstalk 的了解吧!

本研究以短寿命青鳉鱼为模型,探究脑衰老中修饰蛋白质组学的 crosstalk,发现衰老脑内核糖体在赖氨酸、精氨酸等碱性氨基酸密码子区域停滞及碰撞增多,这一翻译延伸异常会触发核糖体质量控制机制介导的40S核糖体亚基(如 RPS3)泛素化升高,而衰老导致的核糖体质量控制相关蛋白减少会进一步加剧紊乱。
同时磷酸化(Ph)、泛素化(Ub)、乙酰化(Ac)与翻译解耦相关(磷酸化相关性最强,Pearson’s r=0.26),核糖体停滞还会引发蛋白错误折叠、不溶性增加,且不溶性蛋白积累与泛素化、磷酸化异常重叠,形成 “翻译异常 - 修饰失衡 - 蛋白聚集” 连锁反应。
此外,长期部分抑制蛋白酶体活性会引发溶酶体异常、线粒体减少等衰老表型,但其对碱性氨基酸富集蛋白的影响与翻译异常相反(前者使其积累、后者使其减少),二者通过不同路径(蛋白酶体抑制作用于溶酶体和线粒体,翻译异常聚焦核糖体与核酸结合蛋白)共同推动蛋白质组重塑。
最终揭示,翻译延伸异常(核糖体停滞)与蛋白质修饰(泛素化、磷酸化)的 crosstalk 是脑衰老核心机制,连接多种衰老标志,且具有组织特异性(脑、肌肉、鳍存在相关现象,肝脏无),为脑衰老及神经退行性疾病研究提供新视角。
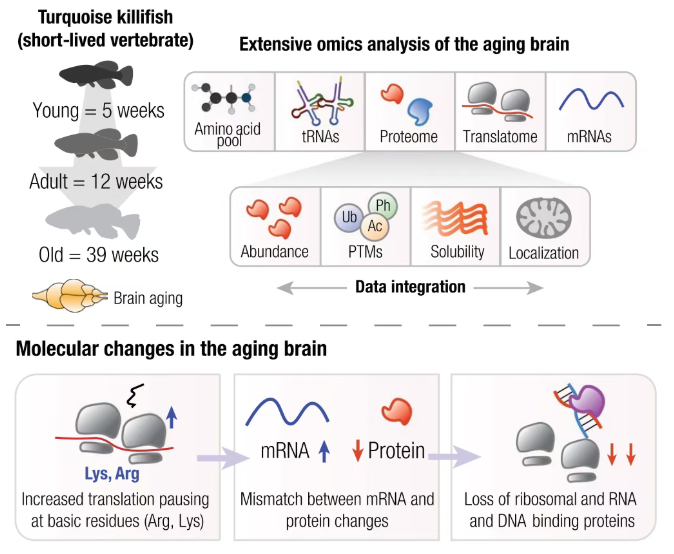
图2 本研究机制图解

本研究以 228 例高级别胶质瘤(含原发性、复发性及 IDH 突变型)为对象,整合磷酸化、乙酰化、糖基化等修饰蛋白质组学数据及基因组、代谢组等多组学信息,探究修饰蛋白质组学间的 crosstalk 及其在肿瘤发生发展中的作用。
研究发现,不同修饰类型间存在广泛协同与调控关联:糖基化与磷酸化在 EGFR 信号通路中相互作用,EGFR 的 N352、N603 糖基化位点与 Y316 磷酸化位点在空间结构上邻近,且在 EGFR 突变型肿瘤中呈正相关,共同调控 EGFR 活性;PTPN11 作为核心信号枢纽,其 Y62 和 Y546 磷酸化位点分别与 PI3K/AKT、MAPK 通路活性相关,且与 IDH1 突变、PDGFRA 表达等协同,连接 EGFR、PDGFR 等上游分子与下游效应器,形成差异化信号网络。
此外,复发性肿瘤中高甘露糖型糖基化蛋白富集,与磷酸化介导的 JNK 通路激活、细胞周期调控紊乱相关,而乙酰化修饰异常则参与染色质可及性调控及肿瘤微环境重塑,这些修饰间的 crosstalk 不仅推动肿瘤异质性形成和复发,还为胶质瘤的分型、复发标志物筛选及靶向治疗提供了新的分子依据。

图3 本研究机制图解

本研究以拟南芥为对象,探究修饰蛋白质组学间的 crosstalk 在叶片衰老调控中的作用,发现 RING 型 E3 泛素连接酶 ATL72 作为叶片衰老的正向调控因子,通过与负调控叶片衰老的蛋白磷酸酶 SSPP 相互作用并对其进行单泛素化修饰,且这一修饰不影响 SSPP 的蛋白稳定性,但会通过减少 SSPP 与衰老促进激酶 AtSARK 之间的离子键数量、削弱二者结合稳定性,显著降低 SSPP 对 AtSARK 的去磷酸化活性;ATL72 的功能依赖 AtSARK,其过表达可逆转 SSPP 过表达导致的叶片衰老延迟表型,而 AtSARK 敲除则会减弱 ATL72 诱导的早衰表型。
最终揭示了泛素化与磷酸化修饰之间的 crosstalk 通过 “ATL72-SSPP-AtSARK” 调控模块,精准调控叶片衰老的起始与进程,为植物叶片衰老的修饰网络调控机制提供了新见解。
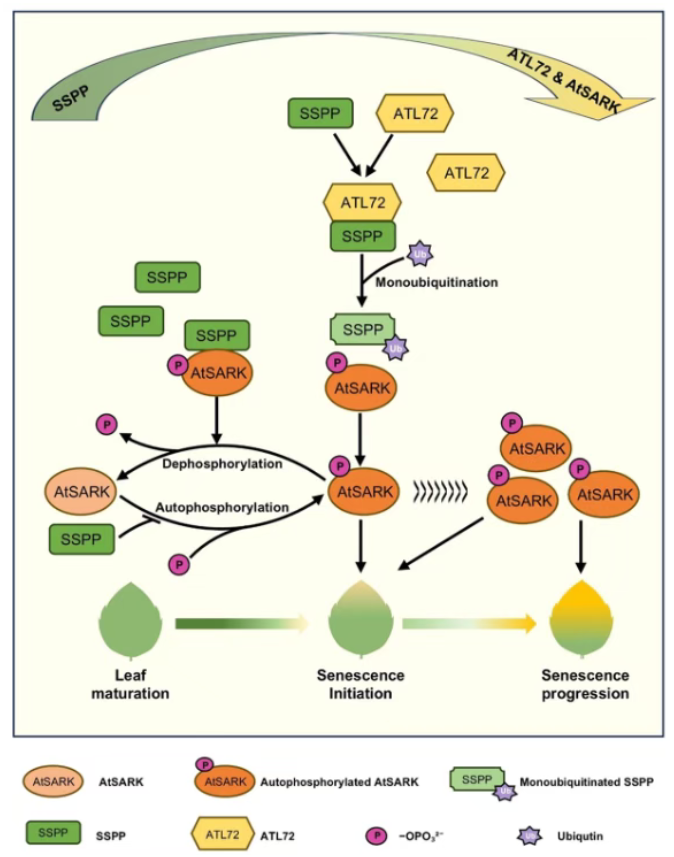
图4 本研究机制图解
经过以上三篇文献的分享,相信大家对修饰 crosstalk 有了更详细的了解,百趣生物推出全景修饰蛋白质组学服务,以 “一站式解决” 为核心优势,打通翻译后修饰研究壁垒,覆盖磷酸化、乳酸化、乙酰化等多种修饰类型,搭配高灵敏度质谱、数据分析报告与专业解读方案,从样本预处理到结果深度解析的闭环服务。
那接下来一起看看我们百趣全景修饰蛋白质组学的项目经验吧!
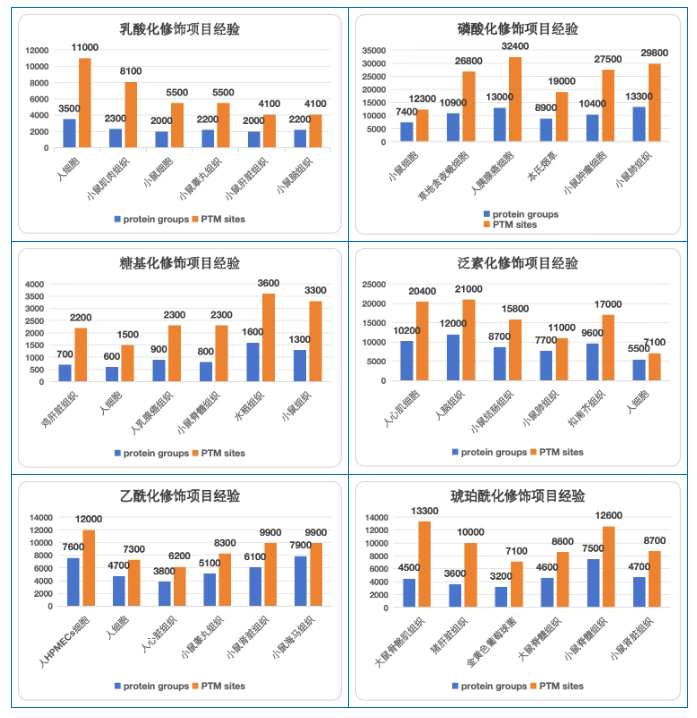
备注:项目数据未发表,故对鉴定数量取整进行展示
基于丰富的实测积累,我们在多种翻译后修饰项目上沉淀了诸多经验:
人胰腺癌细胞最高可以鉴定到3万多个磷酸化修饰位点,人细胞最高可以鉴定到1万多个乳酸化修饰位点,人HpMECs细胞最⾼可以鉴定到1万多个乙酰化修饰位点,人脑组织最高可以鉴定到2万多个泛素化修饰位点,水稻组织最高可以鉴定到3千多个糖基化修饰位点,大鼠骨骼肌样本最高可以鉴定到1万多个琥珀酰化修饰位点。
由于样本类型的丰富性(人细胞、组织、植物等),加之修饰类型的多元化,最终呈现出不同组合下检出位点数量的巨大差异。
修饰间 crosstalk 是生命科学研究中不可或缺的关键环节,它贯穿于生物过程的方方面面,从细胞的基础活动到复杂疾病的发生发展,都有着修饰 crosstalk 的身影。深入研究修饰间 crosstalk,不仅能帮助我们揭示生命活动的本质规律,还能为攻克医学难题、开发创新疗法提供新的思路和方向。
百趣全景修饰蛋白质组学解决方案凭借其先进的技术和丰富的项目经验,在修饰 crosstalk 研究领域独具优势。无论是想要深入探索生命科学奥秘的科研人员,还是致力于解决医学难题的医学工作者,选择百趣全景修饰蛋白质组学解决方案,就是选择了一把开启未知科研世界大门的钥匙。
让我们携手百趣生物,利用这一强大的工具,在修饰 crosstalk 的研究道路上不断前行,挖掘更多生命科学的宝藏,为人类健康事业和科学进步贡献力量,共同开启科研新的篇章。
参考文献:
1.Venne AS, Kollipara L, Zahedi RP. The next level of complexity: crosstalk of posttranslational modifications.Proteomics.2014 Mar;14(4-5):513-24.doi:10.1002/pmic.201300344. Epub 2014 Jan 6. PMID: 24339426.
2.Di Fraia D, et al. Altered translation elongation contributes to key hallmarks of aging in the killifish brain.Science.2025Jul 31;389(6759):eadk3079.doi:10.1126/science.adk3079. Epub 2025 Jul 31. PMID: 40743332.
3.Liu J, et al. Multi-scale signaling and tumor evolution in high-grade gliomas. Cancer Cell. 2024 Jul 8;42(7):1217-1238.e19.doi: 10.1016/j.ccell.2024.06.004. PMID: 38981438; PMCID: PMC11337243.
4.Cao Q, et al. The RING-type E3 ligase ATL72 positively regulates leaf senescence by monoubiquitinating the phosphatase SSPP to impair its dephosphorylation activity in Arabidopsis.Plant Commun.2025Aug 11;6(8):101414.doi:10.1016/j.xplc.2025.101414. Epub 2025 Jun 10. PMID: 40495380; PMCID: PMC12365828.
全景修饰蛋白质组学:作为一种蛋白质翻译后修饰(PTM)研究技术,仅需一份生物样本,即可实现对样本中的多种蛋白质修饰类型进行鉴定与定量分析,能够一次性精准鉴定数千种蛋白质上的上万个修饰位点,有效规避了传统方法因单次仅关注一种修饰类型而导致的大量关键修饰信息遗漏问题。百趣生物推出的全景修饰蛋白质组学技术,目前已实现对多种重要蛋白质翻译后修饰类型的覆盖,包括磷酸化、乙酰化、乳酸化、泛素化、琥珀酰化等。从生物学功能层面来看,这些翻译后修饰可通过改变蛋白质的理化性质、空间构象及活性状态,在细胞信号传导通路调控、物质代谢网络平衡、疾病发生发展的分子机制等核心生理病理过程中发挥不可替代的关键调控作用。