
文章标题:Mogat1 drives metabolic adaptations to evade immune surveillance
发表期刊:nature communications
影响因子:15.7
客户单位:复旦大学、西湖大学
百趣提供服务:新一代代谢组学 NGM
研究背景
免疫检查点阻断(Immune checkpoint blockade, ICB)疗法在实体瘤治疗中虽取得显著临床成效,但多数患者存在初始无应答或获得性耐药问题。当前研究多聚焦于调控 γ 干扰素(interferon-γ, IFNγ)信号通路或抗原呈递机制以解决耐药,但肿瘤其他免疫逃逸机制仍不明确。本文采用体内纵向转录组筛选策略,通过在免疫活性小鼠模型中(MMTV-PyMT 乳腺癌模型)追踪肿瘤进展不同阶段的基因表达变化,捕捉肿瘤在自然免疫压力下的适应性基因调控,以识别与免疫逃逸相关的关键基因。进一步,本文通过对关键调控因子的脂质代谢变化,以探究肿瘤免疫逃逸的机制,为克服 ICB 耐药、改善癌症免疫治疗效果提供新靶点。
研究结果
为了揭示肿瘤免疫逃逸的免疫基础,通过流式细胞术、免疫荧光等方法,每周监测肿瘤进展中CD45⁺免疫细胞及亚群(T 细胞、NK 细胞、髓系细胞等)的浸润数量、比例及空间分布。结果显示随肿瘤进展,CD45⁺免疫细胞的数量和占比显著下降(图 1c-e),免疫细胞与肿瘤边缘的距离增加(图 1h);免疫细胞亚群失衡,淋巴样细胞比例减少,髓系细胞(尤其是髓系抑制细胞 MDSCs)富集,CD8⁺T细胞比例相对上升但绝对数量未显著增加,NK细胞数量增加约5倍(图 1i-j)。该结果在移植模型和自发模型中一致,表明肿瘤进展伴随免疫抑制性微环境形成。
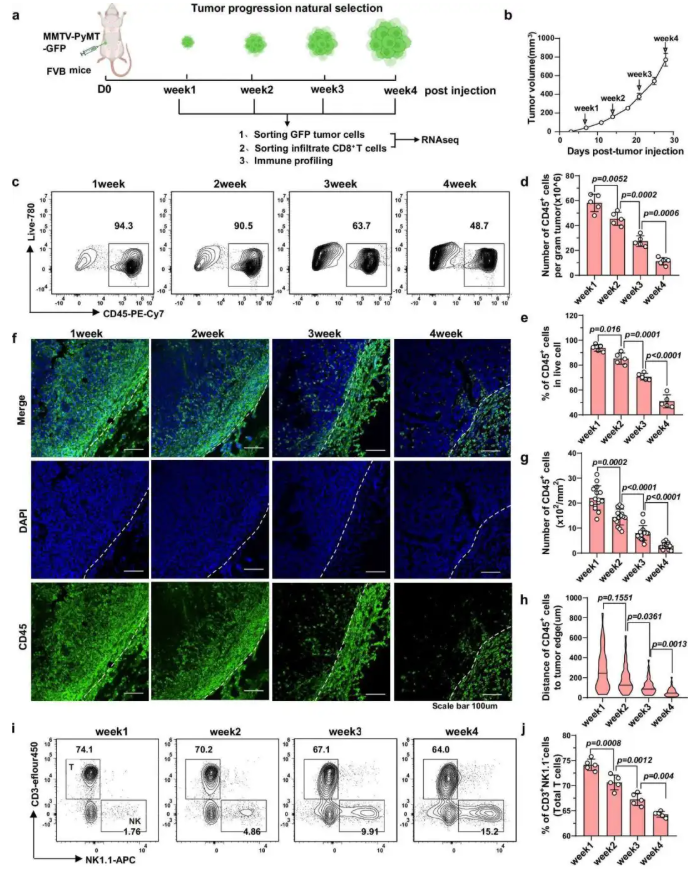
图1. 乳腺癌进展过程中的免疫浸润动态
02 Mogat1 的表达随乳腺肿瘤进展而增加,且与脂质积累相关
为了筛选肿瘤进展中与免疫逃逸相关的关键基因,对不同进展阶段的 MMTV-PyMT 肿瘤细胞进行转录组测序,结合 qPCR、免疫组化及油红 O 染色,分析结果显示转录组筛选发现 34 个持续上调基因,其中 Mogat1 在晚期肿瘤中显著高表达(图 2b-d);晚期肿瘤中脂质代谢通路显著富集(图 2e),油红 O 染色显示脂滴随肿瘤进展增加。临床验证中,人类乳腺癌标本的 Mogat1 RNA 和蛋白表达显著高于癌旁组织(图 2i-j),且与 Ki67⁺ 增殖细胞正相关(图 2k);TCGA 数据显示 Mogat1 在多种癌症中高表达,与不良预后相关。该结果提示 Mogat1 可能通过脂质代谢参与肿瘤进展。
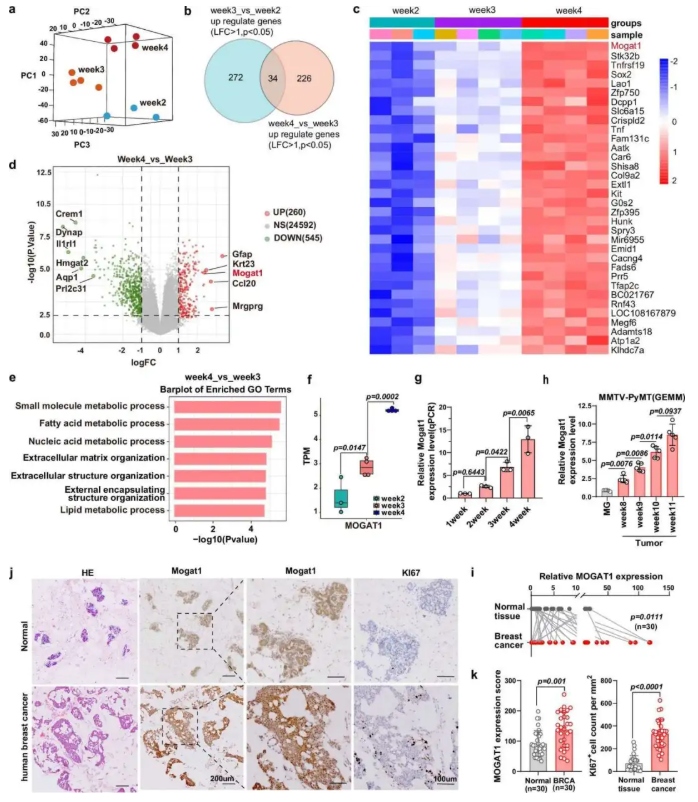
图2. Mogat1 的表达随乳腺肿瘤进展而增加,且与脂质积累相关
为了验证 Mogat1 在肿瘤细胞脂质代谢中的功能,明确其对脂滴形成的调控作用,通过 shRNA 敲低实验以及 Western blot 验证敲低效率,结果显示 Mogat1 定位于内质网(图 3b),敲低后 DAG 和 TAG 含量显著降低(图 3d-e),油红 O 染色和 BODIPY 染色显示脂滴面积减少(图 3f-g),Perilipin 2 标记的脂滴组装受损(图 3h-j);且 Mogat1 抑制不影响脂肪酸摄取(图 3m-n)。该结果证实 Mogat1 通过促进脂质合成调控脂滴形成,是脂质代谢的非冗余调控因子。
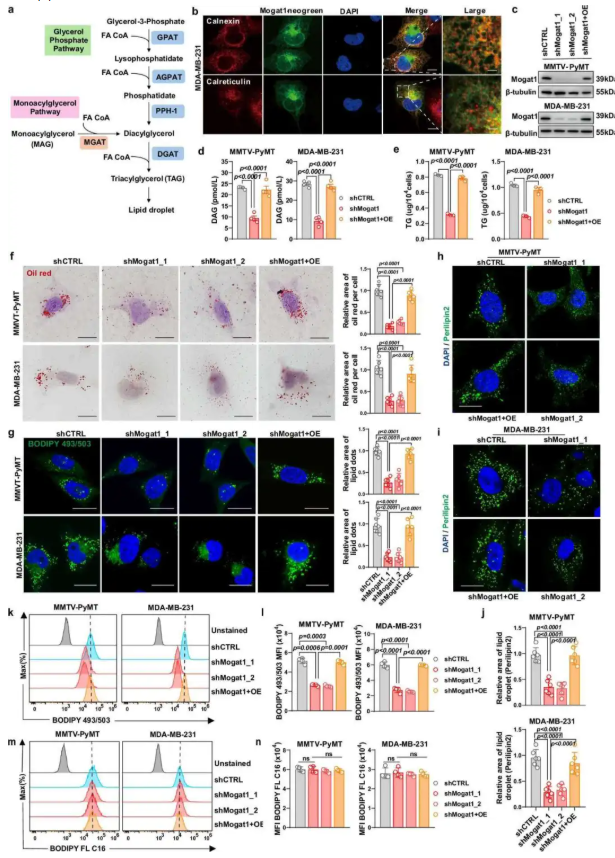
图3. Mogat1 抑制可减少脂滴形成
为了在体内验证 Mogat1 对肿瘤生长的调控作用,明确其是否具有跨癌种的保守性。在 MMTV-PyMT 乳腺癌、4T1 乳腺癌、B16/F10 黑色素瘤等多种小鼠模型中,通过 shRNA 敲低 Mogat1,定期监测肿瘤体积和重量,结合油红 O 染色检测肿瘤组织脂滴变化。研究结果显示,Mogat1 敲低后,MMTV-PyMT(图 4a-c)、4T1(图 4d-f)、B16/F10(图 4g-i)模型的肿瘤体积和重量均显著降低,且肿瘤组织中脂滴面积减少(图 4j-k)。不同癌种模型结果一致,表明 Mogat1 介导的脂质代谢是肿瘤生长的保守机制。
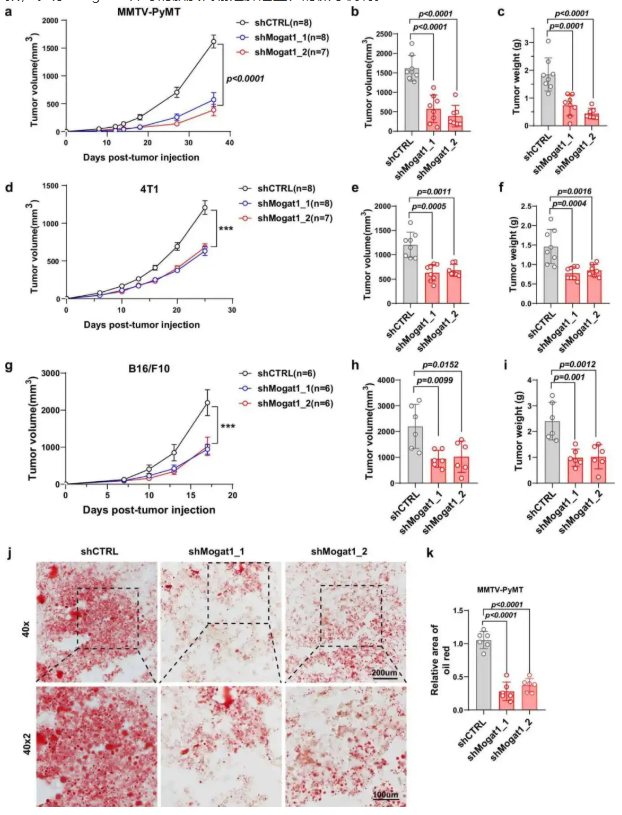
图4. Mogat1 抑制在体内可抑制肿瘤生长
05 Mogat1 抑制可破坏乳腺癌中的脂质稳态和能量代谢
为了探究 Mogat1 抑制对肿瘤细胞整体代谢的影响,揭示其调控肿瘤生长的代谢机制。本文对 Mogat1 敲低的 4T1 和 MMTV-PyMT 肿瘤细胞进行非靶标代谢组学分析,研究结果显示代谢组学 PCA 分析表明敲低组与对照组代谢谱显著分离(图 5a);敲低后中性脂质(DAG、TAG)减少,膜磷脂(PC、PE)异常(图 5c),TCA 循环代谢物(如苹果酸、α- 酮戊二酸)显著下调(图 5e-g);KEGG 分析显示甘油磷脂代谢、脂肪酸代谢、TCA 循环等通路受抑(图 5h)。该结果揭示 Mogat1 通过调控脂质稳态和能量代谢(如 TCA 循环)支持肿瘤生长。
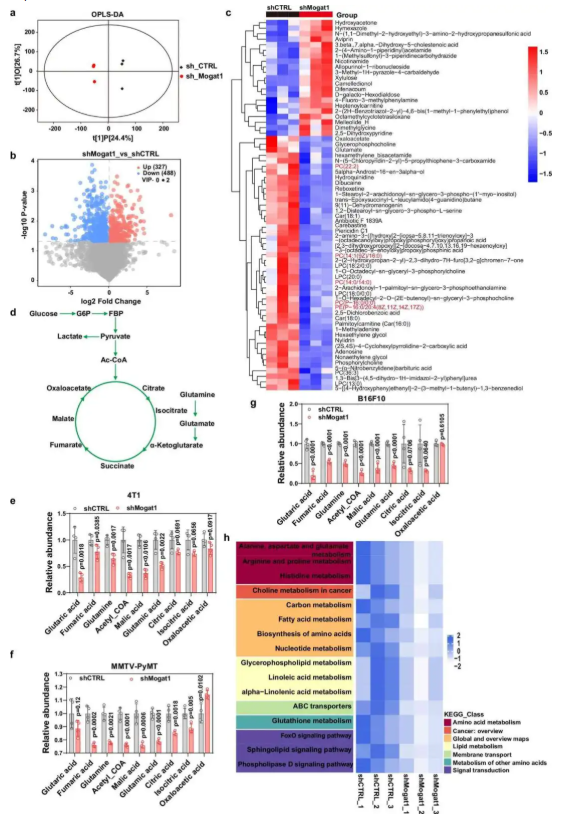
图5. Mogat1 抑制通过抑制三羧酸循环活性重编程乳腺癌细胞代谢
06 Mogat1 缺失可激活肿瘤微环境
为了探究 Mogat1 缺失对肿瘤免疫微环境的影响,明确其是否通过调控免疫浸润参与免疫逃逸。通过流式细胞术分析 Mogat1 敲低肿瘤中免疫细胞(T 细胞、B 细胞、NK 细胞、DCs 等)的浸润变化,检测 CD8⁺T 细胞的效应分子(IFNγ、颗粒酶 B)和耗竭标志物(TOX、CTLA-4)表达,结合 T 细胞共培养杀伤实验验证功能。结果显示Mogat1 敲低后 CD45⁺ 免疫细胞浸润增加(图 6a-d),T 细胞、B 细胞、NK 细胞、DCs 比例上升,TAMs 比例降低(图 6b-g);CD8⁺T 细胞中 IFNγ 和颗粒酶 B 表达增加,耗竭标志物减少(图 6i-j);体外共培养实验显示肿瘤细胞对 T 细胞杀伤更敏感,T 细胞迁移能力增强(图 6k-r)。该结果表明 Mogat1 缺失可重塑免疫微环境,增强抗肿瘤免疫应答。
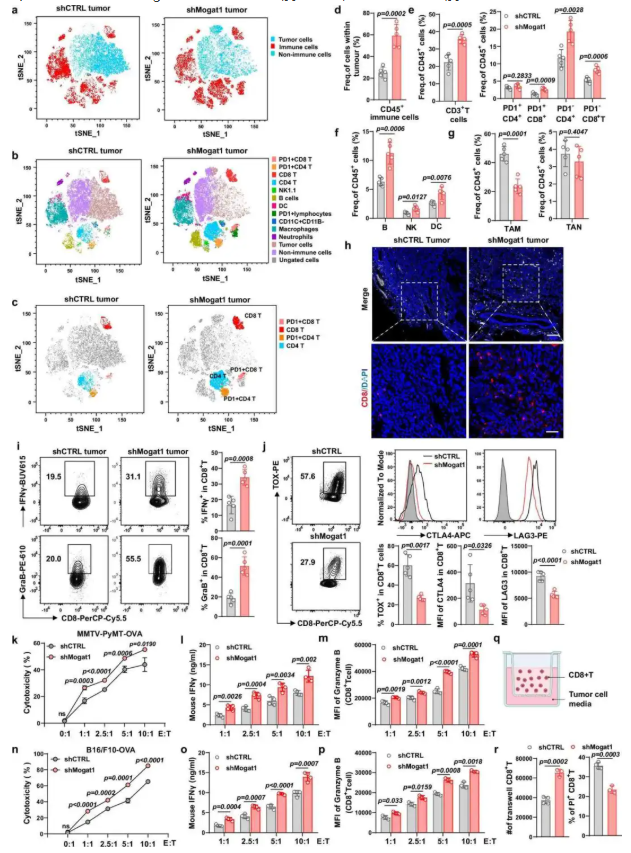
图6. Mogat1 抑制可促进炎症性肿瘤微环境的形成
07 Mogat1 抑制在体内可增强 T 细胞介导的抗肿瘤免疫
为了验证 T 细胞在 Mogat1 抑制抗肿瘤效应中的核心作用,明确免疫依赖性机制。在 MMTV-PyMT 模型中进行 T 细胞耗竭实验,研究结果显示 T 细胞耗竭后,Mogat1 敲低的肿瘤抑制作用消失(图 7c-e);在免疫缺陷 NOG 小鼠中,Mogat1 敲低对肿瘤生长无影响(图 7g-h),而输注人 PBMC 后,敲低组肿瘤生长受抑且人 CD8⁺T 细胞浸润增加(图 7j-l);Rag1⁻/⁻小鼠中 Mogat1 敲低无法抑制肿瘤生长(图 7n-o)。该结果证实 Mogat1 抑制的抗肿瘤效果依赖 T 细胞介导的适应性免疫。
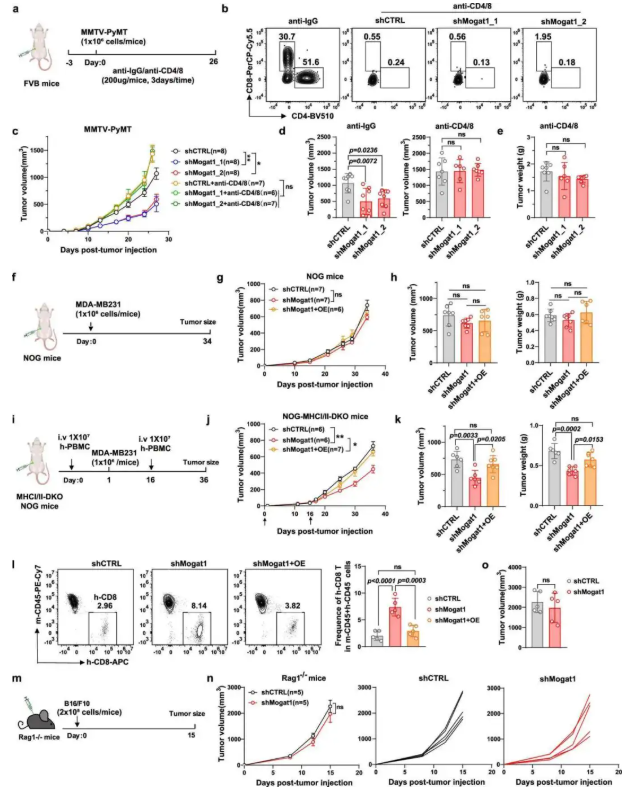
图7. 肿瘤细胞中 Mogat1 的缺失可在体内通过 T 细胞激发抗肿瘤免疫
08 Mogat1 敲低与 PD-1 阻断协同增强抗肿瘤免疫
为了探究 Mogat1 抑制与 ICB 疗法的协同效应,评估其克服 ICB 耐药的潜力。在 MMTV-PyMT 乳腺癌和 B16/F10 黑色素瘤模型中,联合 Mogat1 敲低与 PD-1 阻断疗法,监测肿瘤生长曲线和小鼠生存曲线。研究结果显示联合治疗组的肿瘤生长速度显著慢于单一治疗组(图 8c-d),且小鼠生存期延长(图 8e-f)。机制上,Mogat1 敲低使肿瘤中 PD-1⁺CD8⁺T 细胞比例增加且功能活跃(非终末耗竭),为 PD-1 阻断提供更多靶点。该结果证实 Mogat1 抑制可增强肿瘤对 PD-1 阻断的敏感性,二者具有协同抗肿瘤作用。
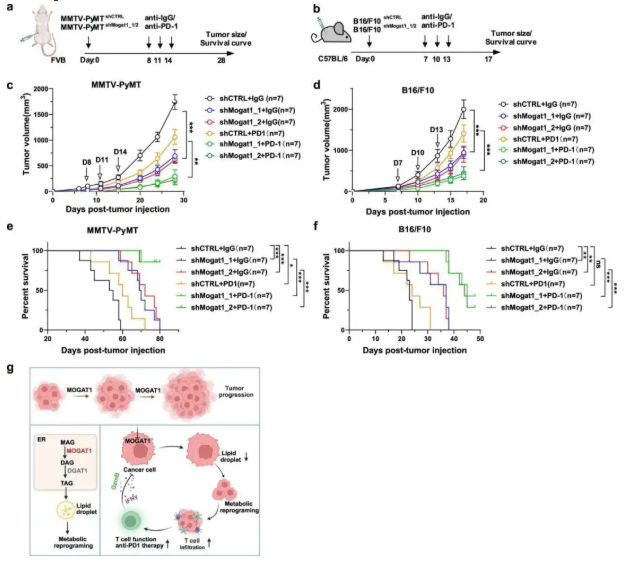
图8. 抑制 Mogat1 可增强乳腺癌和黑色素瘤对抗 PD-1 疗法的应答效果
研究结论
Mogat1 是肿瘤免疫逃逸的关键调控因子,其表达随肿瘤进展逐步升高,通过促进脂肪酸封存为甘油三酯(TAG),既为肿瘤生长提供能量,又营造免疫抑制性微环境。Mogat1 抑制可发挥双重作用:一方面通过减少脂滴积累、重塑代谢通路直接抑制肿瘤生长;另一方面能增强 T 细胞浸润及细胞毒性,有效改善肿瘤免疫微环境。此外,Mogat1 缺失可使肿瘤对 PD-1 阻断疗法敏感,二者联合应用可显著克服免疫检查点阻断(ICB)耐药,进一步增强抗肿瘤效果。临床数据证实,Mogat1 在人类癌症中高表达且与患者不良预后密切相关,提示其作为改善癌症免疫治疗的潜在靶点价值。本研究揭示了以脂质代谢为核心的肿瘤免疫逃逸机制,为代谢调控与免疫治疗的联合应用提供了理论基础。
新一代代谢组学 NGM3:聚焦代谢组学检测的准确度和可靠性,依托 20000+代谢物标准品自建库,搭载Orbitrap Astral质谱仪,以严格四核算法、自动化前处理及全流程质控,全面提升检测结果准确性。另外NGM3借助MetDNA3代谢网络数据库,还能发现此前未被发现的暗物质,帮助突破科研瓶颈。