
文章标题:Gut microbial metabolite targets HDAC3-FOXK1-interferon axis in fibroblast-like synoviocytes to ameliorate rheumatoid arthritis
发表期刊:Bone Research
影响因子:15
客户单位:南方科技大学
百趣提供服务:新一代代谢组学NGM 2 Pro
研究背景
类风湿性关节炎(Rheumatoid Arthritis, RA)是一种全身性和慢性自身免疫性疾病,其特征是炎症、滑膜增生和骨与软骨的破坏,但现有疾病修饰抗风湿药(Diseasemodifying Antirheumatic Drugs, DMARDs)疗效不足,导致患者留存率较低。遗传学已发现百余显著相关位点及数千个小效应因果变异,多数位于难干预的非编码区,仅能解释约15%的RA表型变异。近年肠道菌群失调被证实与RA相关,且宿主遗传可显著塑造菌群组成,但人群中复杂的混杂因素限制了二者因果关系的推断。本研究利用胶原诱导性关节炎(Collagen-Induced Arthritis, CIA)易感DBA/1J小鼠与CIA抗性C57BL/6J小鼠,结合粪便微生物移植(FMT)、16S测序、转录组、蛋白组及代谢组检测,发现遗传背景决定的保护性菌群——脆弱拟杆菌(B. fragilis),其通过产生短链脂肪酸(Short-Chain Fatty Acids, SCFAs)之一的丙酸,破坏RA成纤维样滑膜细胞(RA fibroblast-like synoviocytes, RA-FLSs)中HDAC3-FOXK1相互作用、阻断干扰素信号轴,抑制RA-FLSs的肿瘤样转化并使其失活,进而显著缓解关节炎,为RA提供靶向微生态-代谢-表观调控的治疗新策略。
研究结论
01. C57BL/6J小鼠粪便微生物移植赋予DBA/1J小鼠CIA抗性
为了检测C57BL/6J小鼠是否具有抗关节炎的肠道菌群,收集未免疫的C57BL/6J小鼠和DBA/1J小鼠的粪便样本,并在CIA发病前对DBA/1J小鼠进行了粪便微生物移植(Fecal Microbiota Transplantation, FMT)实验(图1a)。与接受供体DBA/1J小鼠粪便的DBA/1J小鼠相比,接受供体C57BL/6J小鼠粪便的DBA/1J小鼠表现出较低的关节炎评分(图1b)。显微CT和HE染色等组织学结果显示,接受供体C57BL/6J小鼠粪便的DBA/1J小鼠骨侵蚀、滑膜炎症和软骨侵蚀减轻(图1c-d)。骨表面/骨体积比(BS/BV)、骨侵蚀、滑膜炎症和软骨侵蚀的量化一致表明,供体C57BL/6J小鼠和受体DBA/1J小鼠之间的FMT可赋予对CIA的抗性(图1e)。
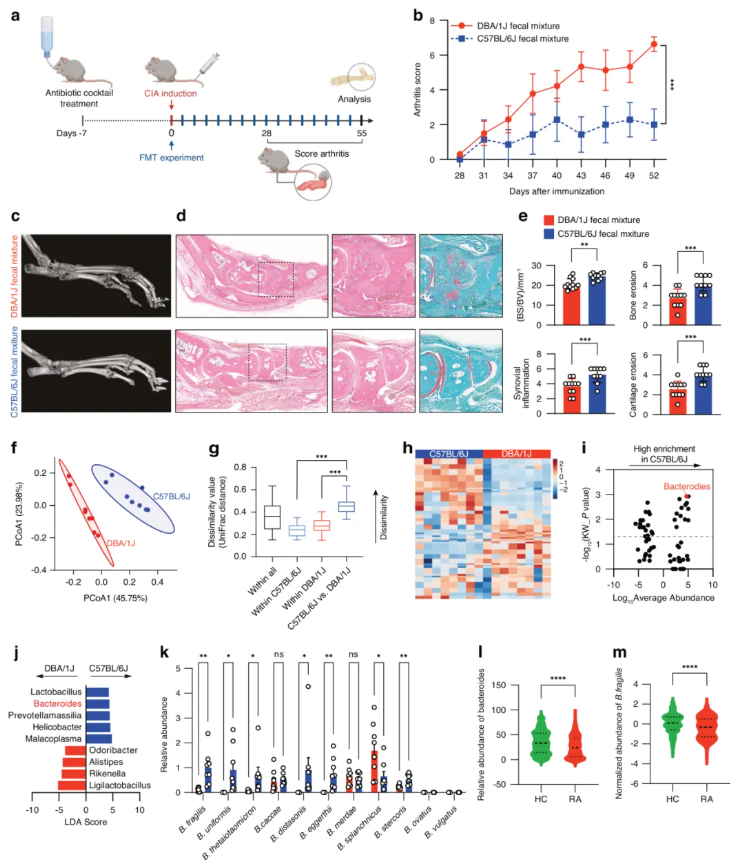
图1. 供体C57BL/6J小鼠与受体DBA/1J小鼠粪便微生物移植及肠道菌群组成差异
02. C57BL/6J和DBA/1J小鼠肠道微生物组成的差异
使用未免疫的DBA/1J小鼠和C57BL/6J小鼠的粪便样本进行了高通量16S rRNA基因测序分析。DBA/1J和C57BL/6J小鼠之间的微生物组成有明显的分离(图1f-g)。火山图显示两个小鼠品系在属水平上的OTUS差异丰富,其中拟杆菌属在C57BL/6J小鼠中富集程度最高且 P 值最低(图1i)。线性判别分析(LDA)结果表明,C57BL/6J小鼠中富集的5个菌属包含拟杆菌属(图1j)。
通过RT-PCR检测未免疫DBA/1J小鼠和C57BL/6J小鼠粪便中人类相关拟杆菌种,发现脆弱拟杆菌(B.fragilis)、埃格特拟杆菌(B.eggerthii)和斯特氏拟杆菌(B.stercoris)在C57BL/6J小鼠粪便中显著富集(图1k)。此外,基于GMrepo数据库比较RA患者与健康对照组(HC)粪便中拟杆菌属及脆弱拟杆菌的丰度,发现RA患者的拟杆菌属和脆弱拟杆菌水平均低于健康对照组(图1l-m)。这些结果表明,脆弱拟杆菌可能与抗关节炎相关。
03. 脆弱拟杆菌移植改善DBA/1J小鼠关节炎
接下来评估了脆弱拟杆菌移植对CIA的保护潜力。在CIA发病前,DBA/1J小鼠经灌胃给予脆弱拟杆菌(实验组)或等量培养基(对照组)(图2a),证实了脆弱拟杆菌的定植效果(图2b)。与对照组相比,脆弱拟杆菌移植显著降低了DBA/1J小鼠的血清IgG水平和关节炎评分(图2c-d),改善了骨质侵蚀、滑膜炎症和软骨侵蚀(图2e-f),证实了脆弱拟杆菌对DBA/1J小鼠关节炎的保护作用(图2g)。此外,还评估了脆弱拟杆菌移植在已建立CIA的DBA/1J小鼠中的治疗潜力。在II型胶原免疫后,给出现关节炎症状的DBA/1J小鼠口服脆弱拟杆菌(实验组),以口服培养基的CIA小鼠为对照(图2h),观察到脆弱拟杆菌在CIA小鼠体内的有效定植(图2i)。脆弱拟杆菌移植可降低CIA小鼠的血清IgG水平和关节炎评分(图2j-k),并抑制骨侵蚀、滑膜炎症和软骨侵蚀(图2l-n)。这些结果表明,脆弱拟杆菌可能是一种有益的肠道细菌,可抑制关节炎的发生与进展。
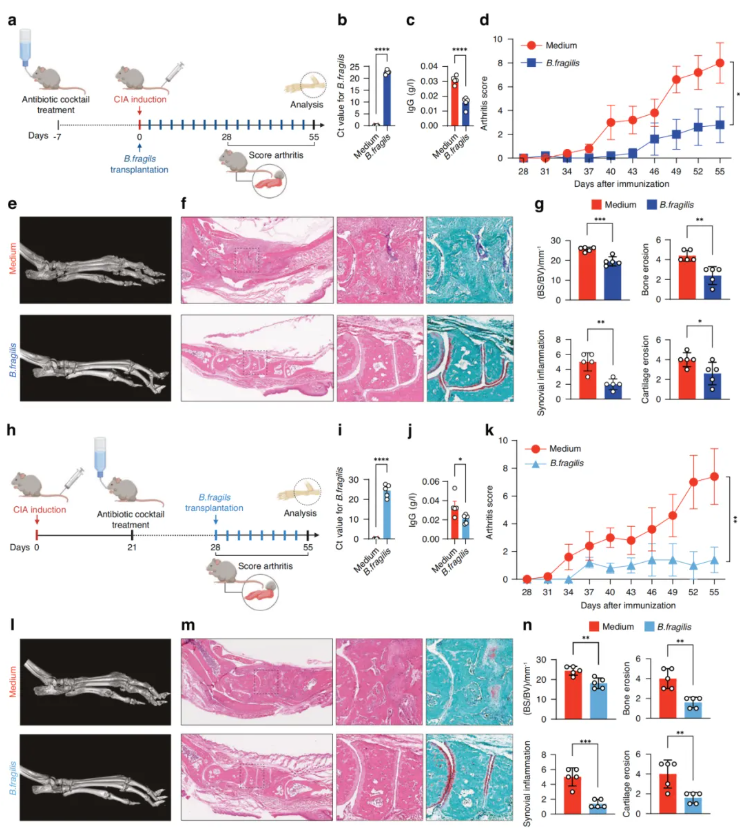
图2. 脆弱拟杆菌移植对DBA/1J小鼠关节炎发展的影响
04. 脆弱拟杆菌衍生的丙酸参与关节炎抵抗
拟杆菌能通过发酵膳食多糖产生各种SCFAs。使用Picrust2软件和MetaCyc数据库,进行了基于16S rRNA基因测序与SCFAs代谢相关的功能预测。与DBA/1J小鼠相比,C57BL/6J小鼠中糖酵解、淀粉降解等与SCFAs产生相关的代谢途径显著富集(图3a)。用GC-MS分析C57BL/6J和DBA/1J小鼠粪便样品中SCFAs的含量,与DBA/1J小鼠相比,C57BL/6J小鼠的丙酸、丁酸和戊酸水平显著更高,而乙酸和异丁酸水平无明显差异(图3b)。由于脆弱拟杆菌是C57BL/6J小鼠的优势菌,且脆弱拟杆菌移植改善了DBA/1J小鼠的关节炎,因此检测了脆弱拟杆菌发酵培养液中丙酸、丁酸和戊酸的水平,并观察到脆弱拟杆菌产生的丙酸比丁酸和戊酸更多(图3c),提示脆弱拟杆菌产生的丙酸可能参与了对关节炎的抵抗。
此外还收集了RA和HC患者的血浆样本,并进行了非靶标代谢组学分析,RA与HC具有显著不同的代谢特征(图3d-g)。代谢富集分析(metabolite set enrichment analysis,MSEA)显示,与HC患者相比,RA患者中TCA循环、丙酮酸代谢等SCFAs相关的代谢途径显著下调(图3h)。结合生化途径和化学关系的代谢网络表明,HC患者的TCA循环、丙酮酸代谢以及淀粉和蔗糖代谢显著富集(图3i)。此外,利用靶标代谢组学检测了血浆样本中丙酸的水平,观察到RA患者的丙酸水平低于HC患者(图3j)。这些结果提示类风湿关节炎患者SCFAs相关的代谢途径异常,导致丙酸的产生减少,对关节炎的抵抗力丧失。
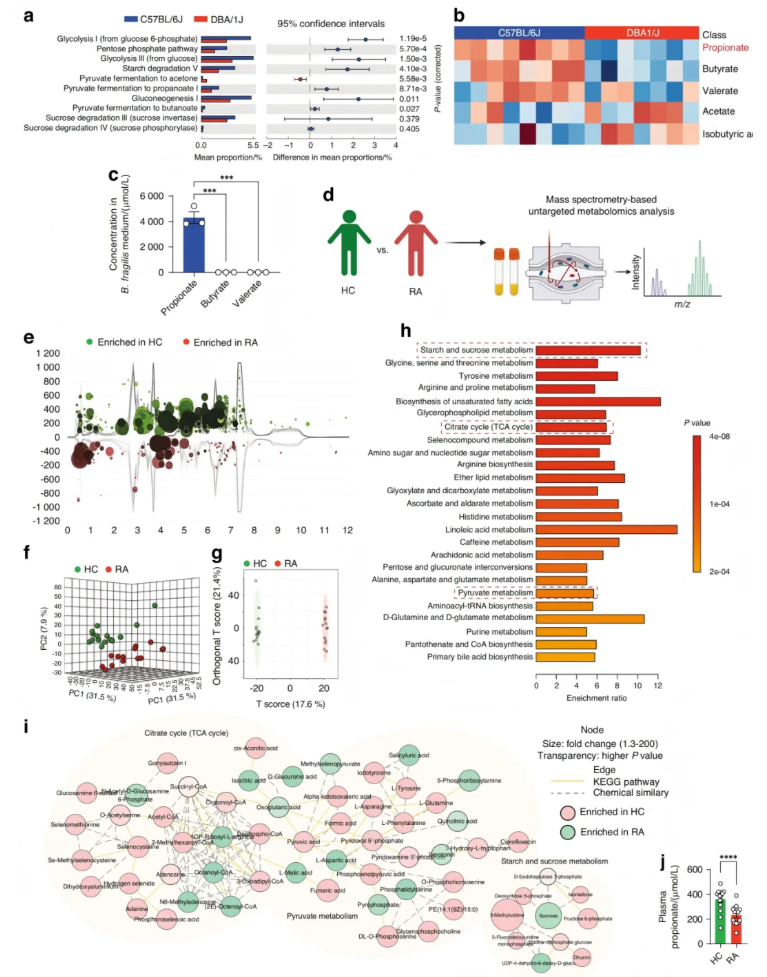
图3. 肠道微生物功能预测及人类血浆代谢组学分析
05. 丙酸体外抑制RA-FLSs的病理表型
在RA的发展过程中,RA-FLSs获得了一系列肿瘤样表型,包括高增殖能力、增强迁移和侵袭、促进抗凋亡等。此外,RA-FLSs还产生如IL-6、IL-1β、TNF-α和MMPs等炎症介质。CCK-8和集落形成实验表明,丙酸在体外以浓度依赖的方式抑制RA-FLSs的增殖(图4a-b)。此外还检测了丙酸对RA-FLSs其他侵袭性表型的影响。Transwell迁移实验、侵袭实验及伤口愈合试验均表明,丙酸处理的RA-FLSs迁移和侵袭能力显著受到抑制(图4c-d)。流式细胞仪分析显示丙酸可促进RA-FLSs的凋亡(图4e)。与对照组相比,丙酸处理的炎症相关基因(MYD88、NF-κB、ICAM、PTPN2和TLR3)、趋化因子和炎性细胞因子(CXCL11、TNF-α、CCL2、IL-6和CXCL8)以及迁移和侵袭相关基因(MMP13、PDGFR和MMP1)的表达均降低(图4f-h)。
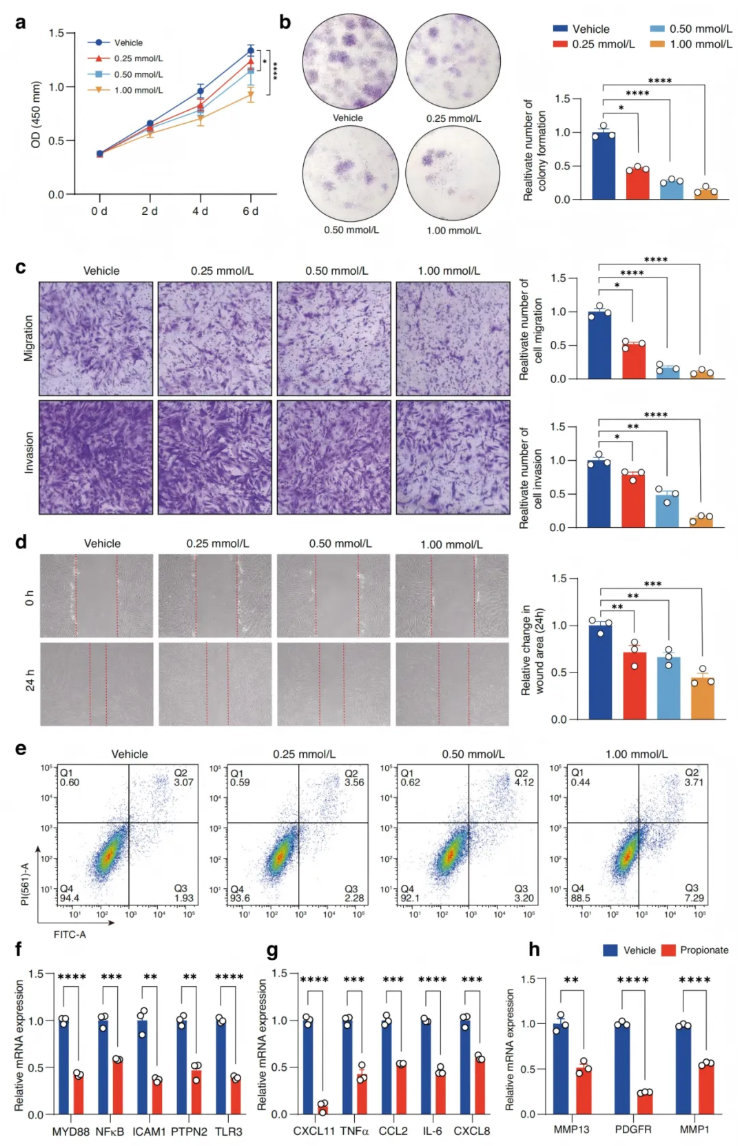
图4. 丙酸对RA-FLSs体外肿瘤样表型的影响
06. 丙酸干扰HDAC3-FOXK1相互作用降低FOXK1蛋白稳定性
为了探讨丙酸抑制RA-FLSs病理表型的机制,对经丙酸或对照(PBS)处理的RA-FLSs进行了RNA测序分析(图5a)。丙酸处理组与对照组的RA-FLSs之间存在大量差异表达基因(图5b)。基因集富集分析(GSEA)显示,丙酸处理后,参与RA-FLSs免疫和瘤样转化的途径显著下调(图5c)。此外,对RA-FLSs进行蛋白质组学分析,检测到两组间存在差异表达的蛋白质(图5d-e)。蛋白功能富集分析表明,丙酸处理的RA-FLSs中,包括干扰素反应、适应性免疫系统和白介素类在内的信号通路显著下调(图5f)。根据RNA测序和蛋白质组学数据进行Venn分析,以筛选丙酸处理后RA-FLSs中共同下调的蛋白编码基因(图5g)。重叠的蛋白编码基因主要参与干扰素途径(图5h),这意味着丙酸主要通过阻断干扰素途径抑制RA-FLSs的病理表型。
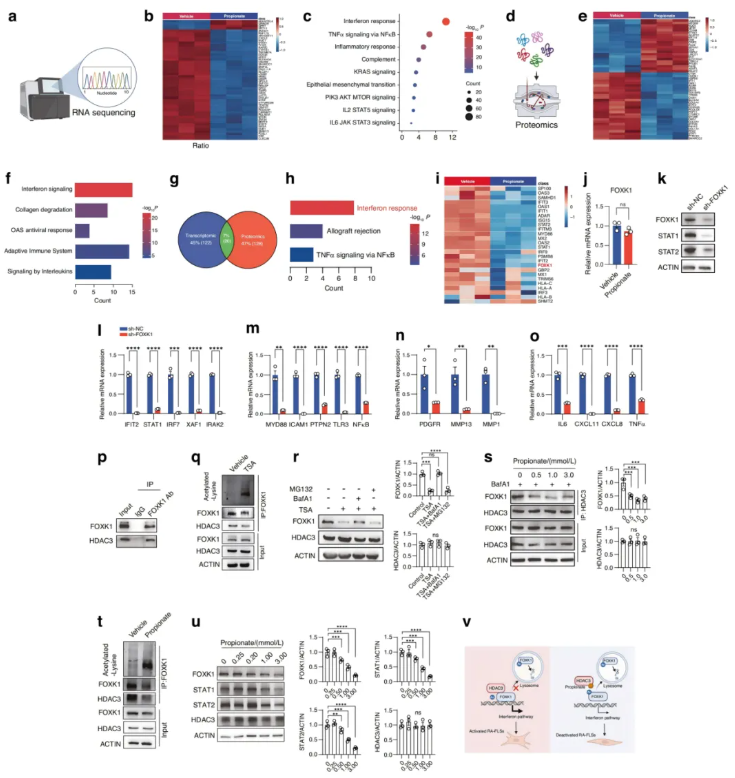
图5. 丙酸处理后RA-FLSs的转录和蛋白质组学分析
为了探索丙酸如何调节RA-FLSs中的干扰素途径,分析了蛋白质组学中两组之间涉及干扰素途径的所有差异表达蛋白(图5i)。在RA-FLSs中,丙酸使FOXK1的表达下调,但在mRNA水平上没有下调(图5i-j)。FOXK1基因敲除抑制了RA-FLSs中干扰素途径基因、炎症相关基因、趋化因子和炎性细胞因子以及迁移和侵袭相关基因的表达(图5k-o)。丙酸是表观遗传调节因子HDAC3的抑制剂。为了测试FOXK1是否是RA-FLSs中HDAC3的新底物,进行了免疫共沉淀试验,结果表明FOXK1与HDAC3有相互作用(图5p)。使用丙酸或另一种HDACs抑制剂曲古抑素A(TSA)来控制HDAC3的活性,TSA以浓度依赖性方式增加了FOXK1的乙酰化水平,并降低FOXK1、STAT1和STAT2的蛋白水平(图5q)。TSA诱导的FOXK1降解可以被溶酶体抑制剂Bafilomycin A1(BafA1)而不是蛋白酶体抑制剂MG132逆转,这表明HDAC3和FOXK1之间的相互作用是保护FOXK1免受溶酶体系统介导的降解以维持干扰素信号所必需的(图5r)。丙酸中断了RA-FLSs中FOXK1和HDAC3之间的相互作用(图5s)。经丙酸处理后,RA-FLSs中FOXK1的赖氨酸乙酰化水平增加(图5t)。丙酸以浓度依赖的方式降低FOXK1、STAT1和STAT2的蛋白水平(图5u)。以上结果表明,在病理条件下,HDAC3与FOXK1相互作用,使FOXK1去乙酰化,通过抑制FOXK1的溶酶体降解而增加FOXK1蛋白的稳定性,导致干扰素信号增强和RA-FLSs的激活;而丙酸破坏HDAC3-FOXK1的相互作用,降低FOXK1的蛋白质稳定性,导致干扰素信号传导受阻,RA-FLSs失活(图5v)。
07. 丙酸单药或与抗TNF药物联合应用缓解CIA小鼠关节炎
接下来研究了丙酸或其与生物类抗TNF药物依那西普联合治疗CIA模型DBA/1J小鼠关节炎的可能性。CIA小鼠分为对照组、丙酸处理组、依那西普单药组及丙酸与依那西普联合处理组(图6a)。治疗后,关节炎评分显示,与对照组相比,丙酸显著阻碍了CIA的进展,骨侵蚀减轻(图6b-d)。H&E和SafO-FG染色的组织学分析显示,丙酸对滑膜增生、骨侵蚀和软骨破坏有显著的抑制作用,测量踝关节BS/BV及定量滑膜评分、骨侵蚀和软骨侵蚀等结果,一致证明丙酸对CIA小鼠有良好的治疗效果(图6e-f)。免疫荧光染色显示,丙酸显著降低CIA小鼠滑膜组织中FOXK1、STAT1、STAT2、IL-6、IL-1β和MMP3的表达(图6g-h)。此外,还评估了丙酸联合治疗的效果,与依那西普单药治疗相比,丙酸与依那西普联合使用更显著地缓解了CIA(图6b-h)。
丁酸已被报道具有治疗RA的潜力,因此还测试了丁酸单药或其与依那西普联合治疗CIA小鼠关节炎的效果(图6a)。结果显示,与对照组相比,丁酸减轻了CIA,减少了骨侵蚀,显著抑制滑膜增生、骨侵蚀和软骨破坏(图6b-d);与依那西普单药治疗相比,丁酸与依那西普联合治疗在缓解CIA方面显示出协同作用(图6b-f)。此外,还比较了丁酸和丙酸的治疗效果,无论是单药治疗还是与依那西普联合治疗后,丁酸在减轻CIA小鼠关节炎方面均不如丙酸有效(图6b-f)。
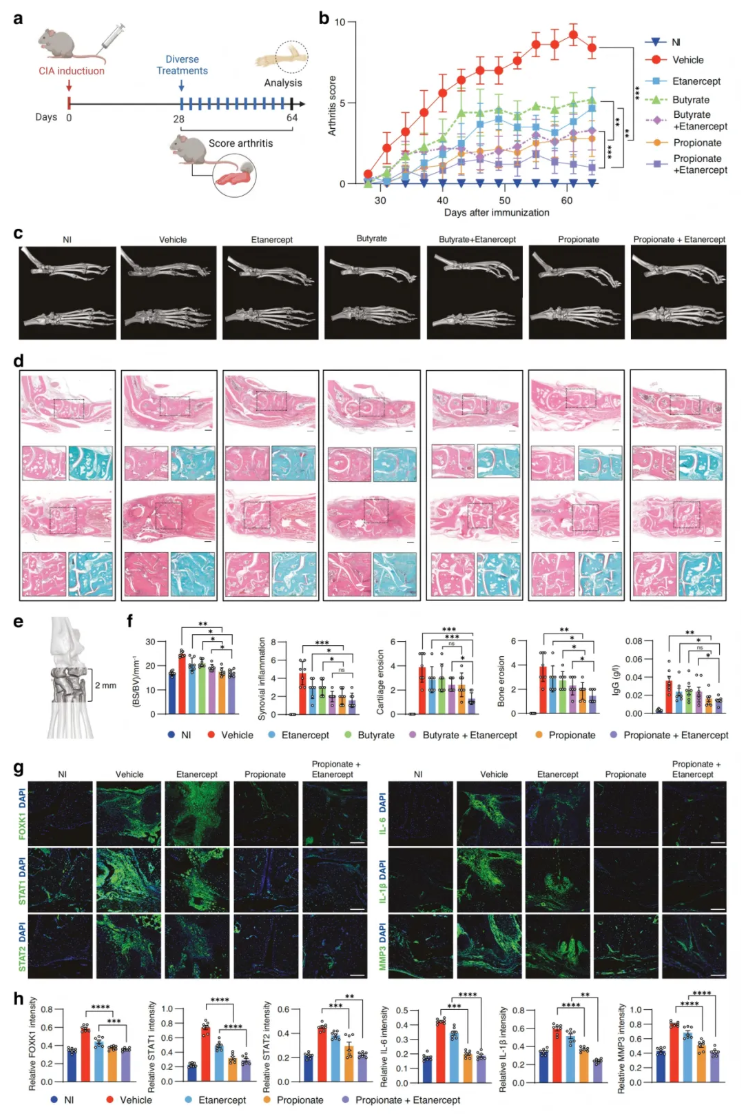
图6. 丙酸单独使用或与抗TNF药物依那西普联合使用对CIA小鼠的治疗效果
研究总结
通过分析CIA抗性小鼠品系和CIA敏感小鼠品系之间的肠道微生物组成差异,本研究揭示了肠道微生物与关节炎易感性之间的因果关系。脆弱拟杆菌是一种抗关节炎的有益肠道细菌,可用于开发以微生物群为导向的类风湿关节炎治疗方法(如脆弱拟杆菌移植)。来源于脆弱拟杆菌的丙酸可抑制RA成纤维样滑膜细胞(RA-FLSs)中的HDAC3-FOXK1-干扰素途径,进而抑制RA-FLSs的肿瘤样转化并使其失活,可作为治疗RA的潜在药物,其单药或与抗TNF药物联合使用均能有效缓解关节炎。
新一代代谢组学NGM 2 Pro:凭借全球领先的2w+代谢物标准品自建库,显著改善代谢组学鉴定准确性不足、数量有限的痛点。其基于LC-MS技术,可检测生物受刺激后小分子代谢物动态变化,助力筛选差异代谢物并关联生理病理。针对代谢物多样性及提取局限,该技术通过多色谱柱联用覆盖非极性/极性代谢物与脂质,结合标准品自建库进一步提升鉴定效率,为标志物筛选、机制研究提供有力支撑。