
英文标题:Ciliopathy-related B9 protein complex regulates ciliary axonemal microtubule post-translational modifications and initiation of ciliogenesis
中文标题:纤毛病相关的B9蛋白复合物通过调控纤毛轴丝微管的翻译后修饰及纤毛生成的起始发挥作用
发表期刊:Journal of Clinical Investigation
影响因子:13.6
客户单位:上海交通大学
百趣提供服务:蛋白质组学
研究背景
原发性纤毛(Primary Cilia)是高度保守的天线状细胞器,广泛存在于哺乳动物非分裂细胞中,起源于母中心粒(Mother Centriole),经历膜囊泡招募、质膜锚定及基体成熟等步骤,最终组装为富含信号蛋白的轴丝微管结构,是调控Hedgehog等关键发育信号通路的核心枢纽,对胚胎发育与组织稳态至关重要。
纤毛结构或功能缺陷会引发多系统表型的遗传性疾病——纤毛病(Ciliopathies),临床表现包括中枢神经系统畸形、肾脏囊肿、视网膜变性、多趾畸形、不孕及肥胖等。其中,Joubert综合征(Joubert syndrome, JBTS)与Meckel综合征(Meckel syndrome, MKS)是两种具有重叠遗传背景和部分临床特征的纤毛病,但MKS通常更严重,常导致围产期死亡,而JBTS患者多可存活至成年。
这两种疾病的致病蛋白高度集中在纤毛过渡区(Transition Zone, TZ)——纤毛基部的选择性屏障区域,负责调控纤毛膜蛋白的定位与信号传导。MKS复合物(含TCTN、TMEM等跨膜蛋白及B9结构域蛋白如MKS1、B9D1/MKS9、B9D2/MKS10)是维持TZ功能的关键。B9蛋白作为核心成员,参与纤毛膜蛋白的富集及信号通路调控,但其在纤毛组装早期和轴丝微管稳定性中的具体机制仍不明确。更关键的是,同一B9基因(如B9D2)的不同变异为何会导致临床表型差异,这一问题长期困扰学界,亟待通过解析B9蛋白在纤毛发生、TZ屏障组装及微管修饰中的双重功能,揭示纤毛病的分子病理基础并推动精准诊疗。
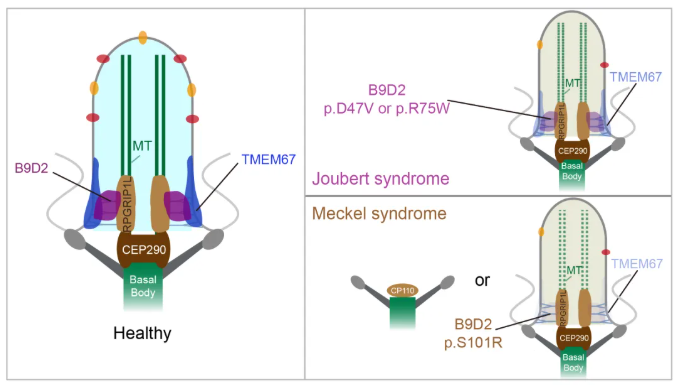
图形摘要
研究结果
1、缺失B9蛋白会削弱纤毛轴丝微管的翻译后修饰
缺失B9蛋白(包括MKS1、B9D1和B9D2等)会削弱纤毛轴丝微管的翻译后修饰,其涉及乙酰化、聚谷氨酰化等。研究聚焦于B9D2功能,通过B9D2-KO细胞的构建与野生型(WT)细胞的比对,发现B9D2-KO细胞纤毛中两种关键的轴丝微管翻译后修饰“乙酰化和聚谷氨酰化”水平显著降低(图1A-D),但二者并未在全细胞范围内发生变化,暗示着这些受损的修饰具有纤毛轴丝微管的特异性。
鉴于B9复合体完整性对其功能的重要性,基于上述结果,在另外MKS1-KO和B9D1-KO细胞系中,同样也发现细胞中的纤毛轴丝微管的乙酰化和聚谷氨酰化水平均有所减少(图1E-G)。此外,这种趋势在其他B9基因敲除细胞系及小鼠NIH-3T3细胞中也一并存在,表明B9复合体在调控纤毛轴丝微管翻译后修饰和纤毛蛋白积累方面的机制在物种间是保守的;同时,也进一步强调了B9复合体(B9D2、MKS1、B9D1)在调控纤毛轴丝微管的翻译后修饰中的核心作用。
2、b9D2基因突变减少轴丝微管的翻译后修饰并导致斑马鱼出现纤毛病表型
为表征b9d2与纤毛病的关联,b9d2-KO斑马鱼品系被构建。然而,在b9d2-KO突变幼体中,其纤毛数量及纤毛乙酰化水平却未受到影响。但当构建母源-合子双缺失型b9d2突变体(MZb9d2)用以消除母源蛋白(Maternal proteins)潜在的补偿作用时,其突变幼体则表现出严重的背部弯曲表型,与野生型(WT)和合子突变体形成鲜明对比(图1H)。此外,MZb9d2突变体脊髓管纤毛轴丝微管的乙酰化和聚谷氨酰化水平也均显著降低(图1I-J)。综上,b9d2在调控纤毛轴丝微管翻译后修饰和纤毛生成中具有进化保守的功能。
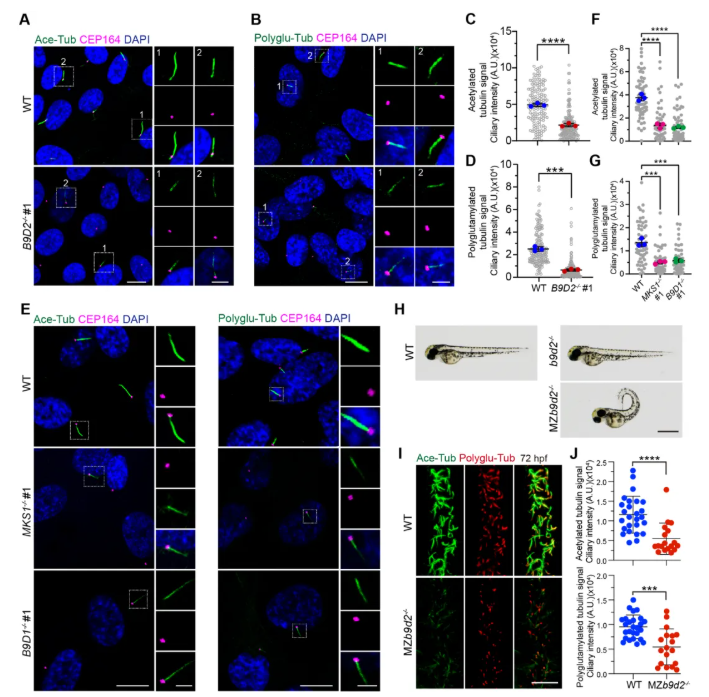
图1 B9D2的丢失减弱了轴丝微管翻译后的修改
3、B9复合体通过锚定TMEM67至过渡区,维持纤毛中蛋白组成与微管修饰
B9蛋白是可溶性成分,主要定位于纤毛膜与轴丝微管之间的TZ。为研究MKS复合体内部的相互作用及B9复合体锚定纤毛膜的机制,结合共免疫沉淀(Co-IP)与质谱分析,筛选鉴定出相关的蛋白互作网络,并利用STRING在线工具进行聚类分析(图2A)。
此外,TMEM67是一种定位于TZ的纤毛膜蛋白,其突变与MKS和JBTS相关。在Co-IP验证中,TMEM67被证实与B9D2及MKS1之间存在互作关系(图2B)。为深入剖析,TMEM67-KO细胞系被进一步构建(图2C)。结果显示,TMEM67-KO细胞亦表现出纤毛生成受损,其轴丝微管的乙酰化和聚谷氨酰化水平也显著降低(图2C-E)。此外,在B9D2-KO和MKS1-KO细胞中,也观察到TMEM67在TZ的定位显著受损,其与野生型(WT)细胞形成鲜明对比(图2F);相反,两个NPHP模块成员(CEP290和RGPRIP1L)的定位未受影响(图2G),亦表明B9复合体是TMEM67定位于TZ的必需因子(图2H)。因此,B9复合体通过与TMEM67互作并稳定其在TZ的定位,与TMEM67共同构成一个功能模块,从而维持轴丝微管的翻译后修饰及纤毛稳定性。
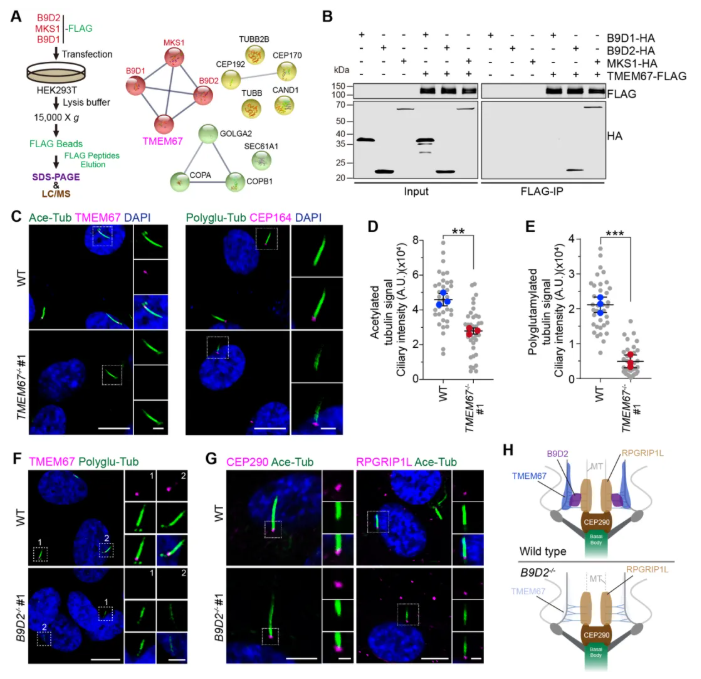
图2 B9复合体在TZ处锚定TMEM67以维持轴丝微管的改变
4、B9-TMEM67亚复合体通过将胞质酶排除在纤毛外,维持纤毛在环境变化中的稳定性
现有植物研究表明,TZ缺陷从而导致纤毛内膜蛋白和非膜蛋白的异常分布。同样地,在TZ缺陷的哺乳动物纤毛中,可溶性蛋白的错位亦是可能存在的。根据前文结果,结合上述论断,若在缺乏完整TZ的情况下,关键的去乙酰化酶HDAC6可能错位进入稳态纤毛,从而降低微管乙酰化水平。为验证这一猜想,带有FLAG标记的HDAC6在WT、B9D2-KO和TMEM67-KO细胞中被稳定表达(图3A-B)。结果显示,HDAC6在WT纤毛中缺失,但在B9D2-KO和TMEM67-KO细胞的纤毛中均被检测到(图3A-C),尽管含有HDAC6的纤毛比例相对较低(图3C)。此外,另一种定位于中心体和纤毛的谷氨酰化酶TTLL5也被发现在B9D2-KO细胞中分布紊乱。因此,TZ缺陷会广泛破坏纤毛内可溶性蛋白的双向运输。
微管乙酰化水平的降低已被证实与轴丝稳定性下降相关,其会加速纤毛解离。为进一步解析二者关联,通过血清添加实验,监测纤毛在解离过程中的稳定性(图3D)。如图3E-F所示,当血清刺激6小时后,B9D2-KO细胞中仅41.5%保留纤毛,且残留纤毛长度显著短于WT细胞。此外,应用HDAC6抑制剂‘Tubacin’处理后,在B9D2-KO和TMEM67-KO细胞中,它们的整体微管和纤毛轴丝微管的乙酰化水平显著升高(图3G-I),而WT细胞变化不大,表明HDAC6在这两种细胞的纤毛中具有功能活性。由此推断,B9D2-KO细胞中纤毛稳定性较低可能与HDAC6的异常进入有关,从而解释了其纤毛生成率的下降。然而,结合活细胞成像显示(图3J),正常条件下B9D2-KO细胞中纤毛存在时间与WT细胞相当(图3K),尽管其轴丝稳定性下降,但纤毛生成率降低的原因可能另有机制。综上,B9-TMEM67亚复合体通过将胞质酶(如HDAC6)排除在纤毛外,在环境变化中维持纤毛稳定性。
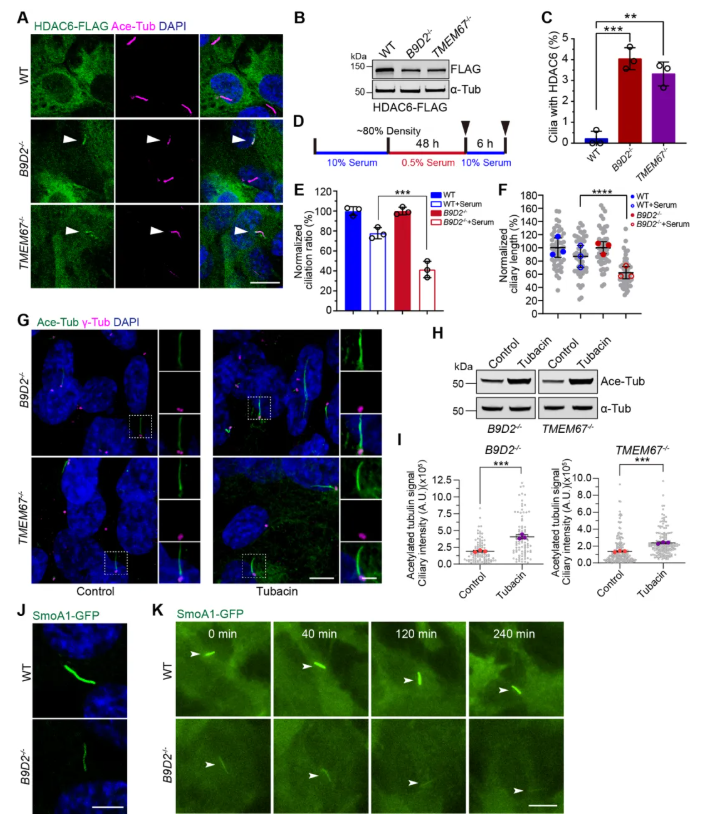
图3 破坏B9-TMEM67复合体不能将HDAC6排除在纤毛外,并降低纤毛轴线的稳定性
5、B9复合体是纤毛生成早期步骤所必需的
如图4A所示,纤毛生成涉及多个细胞过程步骤(Step1-4)。由此推测,B9蛋白缺失引发的TZ功能障碍相关表型,可能是Step3受损所致,即B9复合体破坏的细胞无法组装完整的TZ。透过电镜分析,B9D2-KO细胞中母中心粒缺乏相关的纤毛囊泡(PCVs/DAVs)(图4B)。此外,与WT细胞相比,B9D2-KO细胞在血清饥饿后无法有效移除母中心粒上的CP110蛋白(图4C-D)。因此,B9蛋白在纤毛生成早期阶段(如PCVs的募集和结合)发挥关键作用。值得注意的是,B9D2和MKS1定位于增殖细胞的母中心粒(图4E-F),且其定位与母中心粒标记蛋白CEP164邻近(图4G)。这一定位早于纤毛组装(如CP110移除),表明B9复合体可能通过母中心粒的锚定招募PCVs,启动纤毛生成。综上,B9亚基的缺失会破坏纤毛生成的早期步骤,即在TZ组装之前。
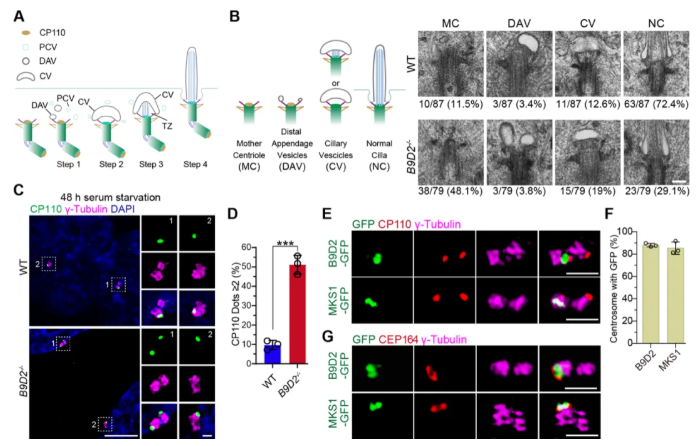
图4 B9蛋白在纤毛形成早期事件中的作用
6、B9D2保守氨基酸替换的人类变异与JBTS相关
在151例中国JBTS患者队列中,通过全外显子测序,筛选出两名患者携带有B9D2基因(NM_030578.3)的双等位基因变异(图5A),二者均存在典型的小脑蚓部发育不全(图5B),其具体变异如图5C所示。
通过SpliceAI预测、RT-PCR及测序验证,这些变异在对照组数据库(dbSNP/gnomAD)中未检出,且错义变异c.140A>T和c.223C>T在gnomAD中频率极低,无纯合记录。透过进化保守性分析,Asp47和Arg75位点高度保守(图5D)。结合多算法(SIFT、PolyPhen-2及AlphaMissense)预测,发现这些变异具有潜在致病性。根据ACMG指南,上述变异可被归类为致病或可能致病,支持其与JBTS的因果关系。此外,基于高精度蛋白结构预测模型,JBTS相关残基(Asp47、Arg75)及已报道的MKS相关残基Ser101均位于B9D2蛋白二级结构的过渡区域(图5E)。这些保守位点的电荷或极性改变可能破坏B9D2的构象,影响其生物学功能,进而表现病症。
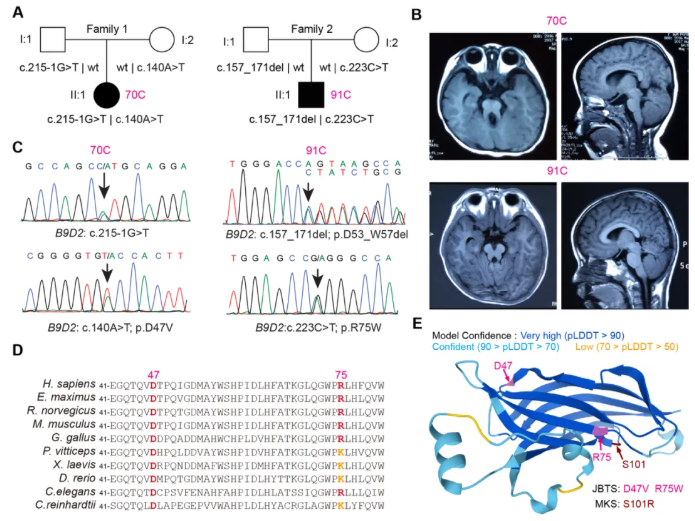
图5 B9D2基因变异与JBTS相关
7、与JBTS相关的B9D2变异在功能上与MKS相关变异存在差异
为阐明B9D2基因变异导致纤毛缺陷及相关临床异常的机制,RPE1细胞中的JBTS和MKS相关的变异的潜在致病效应被用于比较(图6A-H):(1)对于JBTS变异(p.D47V/p.R75W),其不仅可恢复纤毛生成并诱导母中心粒CP110移除,还保留与MKS1的结合能力,能够形成部分功能复合体,同时TZ富集程度降低(图6B-C),蛋白/mRNA水平仍与WT相当。(2)对于MKS变异(p.S101R),其不仅纤毛生成严重缺陷,CP110移除受阻,完全丧失复合体组装能力,导致TZ“门控”功能崩溃,而且TZ定位几乎消失,蛋白水平显著下降,但mRNA却未减少;同时,MKS变异因构象改变导致蛋白降解加速(图6G)。因此,JBTS与MKS相关的B9D2变异存在分子功能差异,其中,JBTS变异保留部分功能,MKS变异则功能完全丧失。
此外,无论携带哪种变异,ARL13B、INPP5E及轴丝微管的乙酰化/多谷氨酰化水平均显著降低(图7A-C,E-F),亦表明B9复合体功能受损影响纤毛膜蛋白富集。TMEM67在变异细胞中主要无法定位于TZ(图7G-H),但其与B9D2变异的相互作用能力未受损(图7I),进一步支持了“TZ定位减少导致门控失常”的机制。
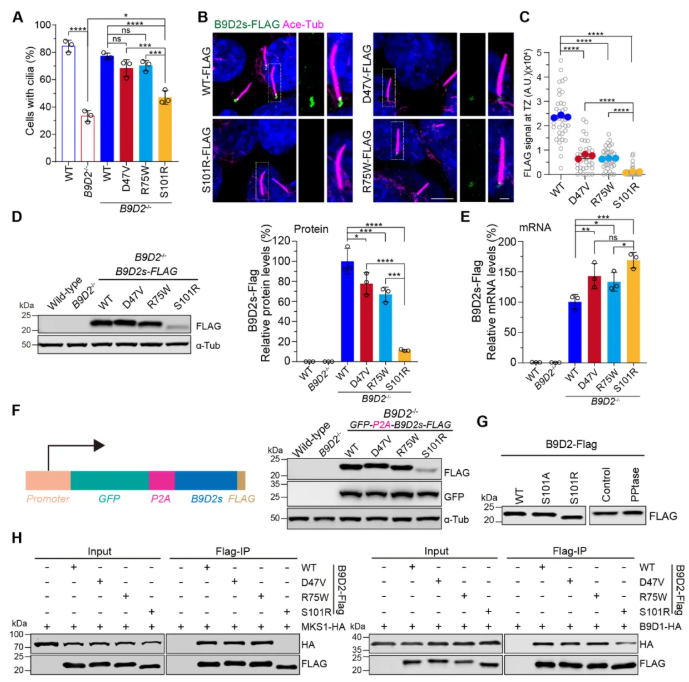
图6 与JBTS和MKS相关的B9D2变异均会削弱其在TZ的定位,但仅MKS相关变异通过破坏B9复合体的相互作用影响纤毛生成
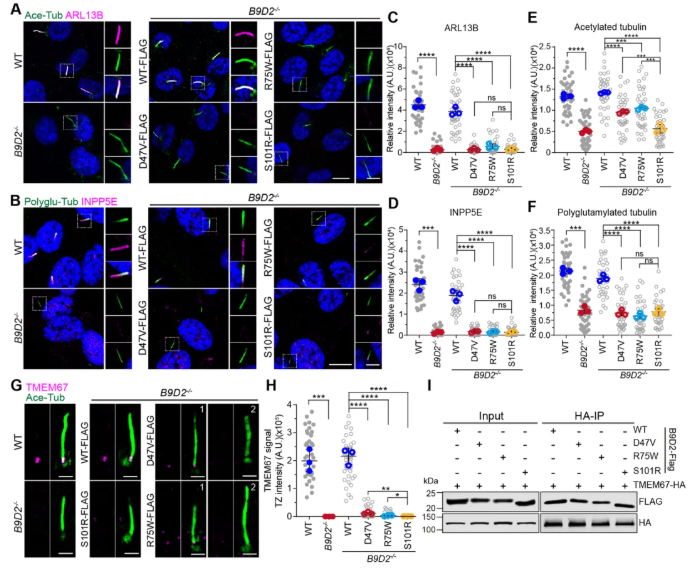
图7 B9D2基因的纤毛病相关变异损害纤毛完整性
研究小结
本研究聚焦纤毛病,阐明了B9蛋白在TZ的“守门人”功能,并揭示了其两大关键作用:(1)B9复合体与TMEM67相互作用并将其锚定于TZ膜。破坏该复合体会因纤毛内微管修饰酶失调,导致轴丝微管翻译后修饰减少。(2)B9蛋白在纤毛生成前定位于中心粒,能够促进纤毛生成的启动。此外,在中国患者队列中发现的B9D2变异进一步表明:JBTS相关变异主要影响轴丝微管修饰,不干扰纤毛生成;MKS相关变异则同时破坏纤毛生成与微管修饰。综上,B9复合体不仅作为纤毛膜蛋白的“守门人”,还调控轴丝微管修饰及纤毛生成早期事件,为同一基因不同变异导致异质性纤毛病提供了机制解释。
全景修饰蛋白质组学:作为一种蛋白质翻译后修饰(PTM)研究技术,仅需一份生物样本,即可实现对样本中的多种蛋白质修饰类型进行鉴定与定量分析,能够一次性精准鉴定数千种蛋白质上的上万个修饰位点,有效规避了传统方法因单次仅关注一种修饰类型而导致的大量关键修饰信息遗漏问题。百趣生物推出的全景修饰蛋白质组学技术,目前已实现对多种重要蛋白质翻译后修饰类型的覆盖,包括磷酸化、乙酰化、乳酸化、泛素化、琥珀酰化等。从生物学功能层面来看,这些翻译后修饰可通过改变蛋白质的理化性质、空间构象及活性状态,在细胞信号传导通路调控、物质代谢网络平衡、疾病发生发展的分子机制等核心生理病理过程中发挥不可替代的关键调控作用。