
英文标题:Metabolomic and Single-Cell Transcriptomic Analyses Shed Light on Secondary Metabolite Profiling and Potential Developmental Dynamics of Glandular Trichomes in Artemisia argyi
发表期刊:Plant Biotechnology Journal
影响因子:10.5
研究背景
腺毛(Glandular trichome, GTs)作为天然工厂,能合成并积累倍半萜、黄酮类等多种次生代谢物,其中倍半萜因其复杂的结构和广泛的生物活性尤为关键。艾草(Artemisia argyi)作为传统中医药重要材料,广泛用于艾灸疗法,并在端午节等东亚文化中具有驱蚊、祈福等象征意义。尽管基因组和转录组研究已揭示其TPS基因家族的扩张及部分候选基因功能,但现有研究多局限于组织水平,单细胞层面的GTs发育与代谢调控机制仍不明。本研究通过整合代谢组学、单细胞转录组学和体外酶活性分析,首次解析了艾草GTs的代谢特征与发育动态,明确了其与非GTs的代谢差异,并构建了倍半萜合成的细胞特异性共表达网络,为药用植物特化代谢研究提供了新范式。
研究结果
01艾草GTs与NGTs的比较代谢组学分析
艾草叶片表面密布GTs和NGTs, 其中,NGTs在叶片腹面的密度高于背面,导致叶片腹面呈灰绿色、背面为绿色(图1a)。结构上,GTs为多细胞盾形结构,NGTs为T型结构(图1b),通过优化机械分离技术,实现了高纯度、高完整性的GTs与NGTs分离(图1c)。在代谢物差异上,总计969种差异积累代谢物(DAMs)被鉴定(图1d-e),其中GTs中富集的代谢物占比远高于NGTs。聚焦DAMs,可以发现,萜类化合物是GTs中最主要的代谢物类别,倍半萜尤为突出(图1e-f);类黄酮在GTs中显著富集(图1h),其亚类黄酮糖苷和黄酮醇是核心组成;脂肪酰类化合物中,二十烷酸和脂肪酸主要在GTs中积累(图1e,g)。此外,KEGG富集分析显示,GTs代谢物显著富集于倍半萜与三萜生物合成、ABC转运体、苯丙素类合成等次生代谢核心通路,进一步验证了GTs作为药用活性物质合成工厂的功能。这些结果为解析艾草GTs的发育与代谢调控机制提供了关键分子基础,并为药用植物次生代谢研究提供了新的单细胞层面的视角。
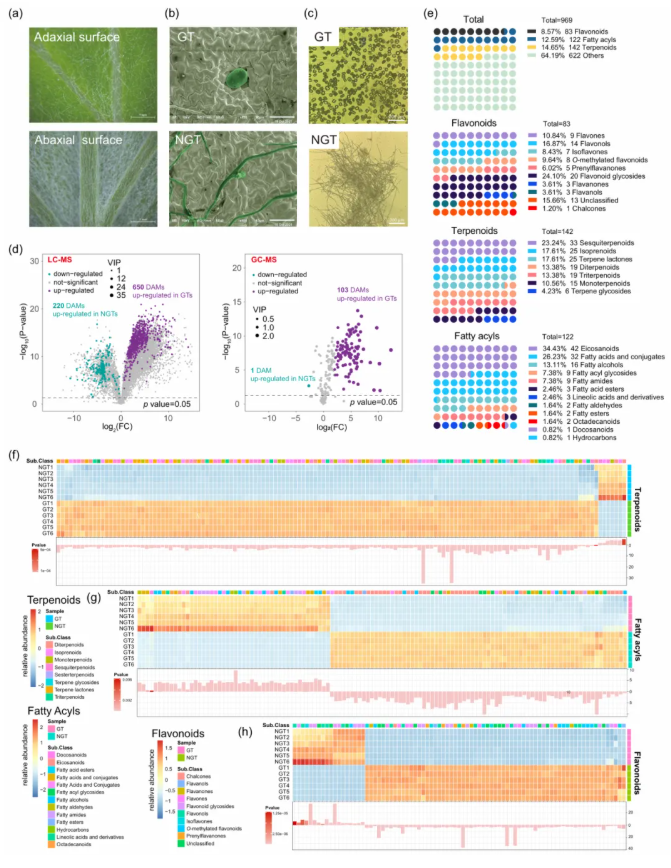
图1 艾草GTs和NGTs的代谢组学研究
02构建艾草叶片的单细胞转录组图谱
通过单细胞转录组学技术,艾草叶片的高分辨率细胞图谱首次被构建,主要内容如下:
1、利用10x Genomics平台从组织培养嫩叶中分离原生质体,获得24,174个初始细胞数据,经严格质控后保留22,032个高质量细胞,平均每个细胞约30,582条reads,中位表达基因1595个(图2a-b)。
2、通过UMAP无监督聚类,将艾草叶片分为18个细胞簇(图2c),其中叶肉细胞(Mesophyll cells,MCs)占主导地位(九个簇),维管细胞(Vascular cells, VCs)分布于四个簇,表皮细胞(Epidermal cells,ECs)单独形成簇8,其余四个簇因缺乏特异性标记基因被归类为未知类型(Unknown cell types,UN)。
3、基于同源标记基因分析,结合功能富集(GO)结果,明确了三大核心细胞类型(图2d,h):MCs、VCs、ECs。
4、通过RNA原位杂交实验(图2e-f)和GO功能分析(图2g-h),证实了MCs和ECs分类的可靠性,为后续研究提供了坚实的细胞类型注释基础。
综上,单细胞转录组图谱的构建为解析艾草GTs的发育与代谢调控机制提供了关键分子框架,并推动了药用植物特化代谢研究的单细胞层面进展。
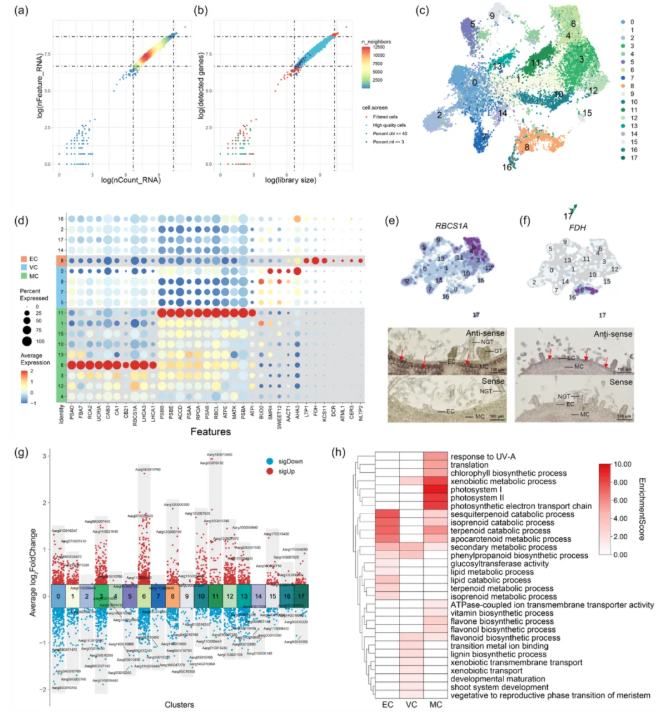
图2 艾草单细胞转录图谱的构建
03子聚类分析区分了艾草的GT细胞类型
通过子聚类分析和多组学验证,艾草叶片中GTs的细胞类型被精准区分,其主要内容如下:1、在腺毛细胞类型鉴定中,首先,通过UMAP子聚类分析,ECs(Cluster 8)被初步鉴定,在分辨率0.4下可将其划分为5个子簇(EC_0-EC_4)(图3a-b)。其次,利用腺毛标记基因同源物的特异性表达,确认EC_1为GT细胞类型(图3c)。最后,结合RT-qPCR验证,发现腺毛标记基因在手动刮取的毛状体(Trichome, TR)中显著高于无毛状体组织(Petiole tissue devoid of epidermis, PNE),进一步支持了EC_1的腺毛注释(图3d-e)。2、在代谢功能注释中,透过GO富集分析,腺毛(EC_1)中偏好表达的基因显著富集于脂肪酸延长、角质层发育、脂质转运和类黄酮生物合成等次生代谢相关过程(图3c,h)。结合批量RNA-seq比较,富含腺毛的叶柄表皮(Petiole epidermis)中上调基因和PNE中下调基因均富集于脂肪酸生物合成和脂质转运通路(图3f-i),表明腺毛所在表皮组织是次生代谢的核心场所。其中,EC_1中高表达的基因与腺毛中次生代谢物的合成与转运功能相关(图3j,k),并通过RT-qPCR验证了其中两个关键基因(LTP和POD)在TR中呈现特异性高表达(图3l)。3、对于其他表皮细胞类型注释,EC_4因特异性表达气孔保卫细胞(stomatal guard cell,GC)标记基因同源物(如LIGB、GSTT1、OPR1、BI-1),被注释为GC,其表达模式与公开单细胞数据集一致。EC_0、EC_2和EC_3因缺乏特性标记基因,被归类为EC和UN(图3c)。
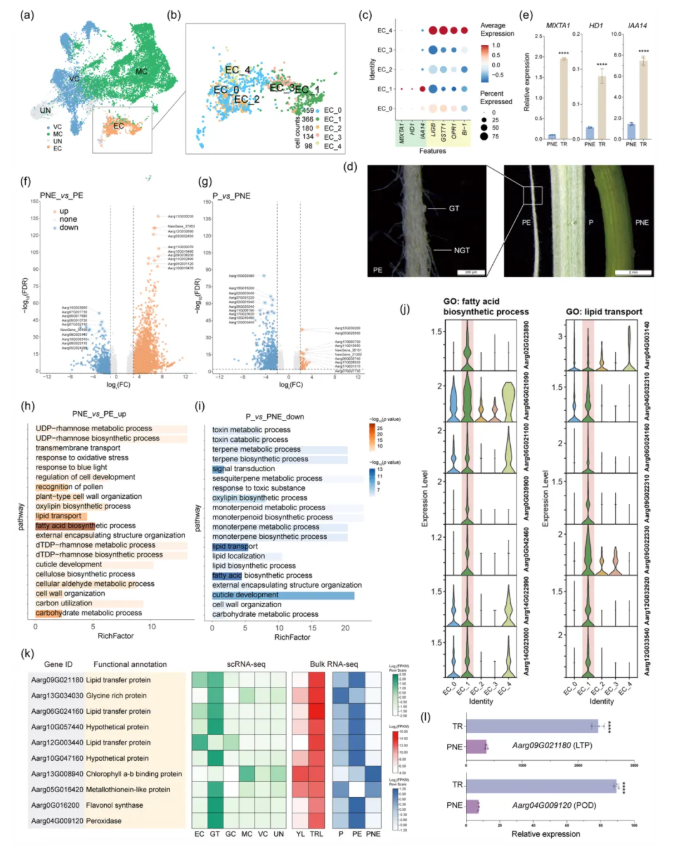
图3 艾草叶中GT细胞类型的鉴定
04艾草GTs的发育轨迹分析
为阐明艾草GTs的发育轨迹,利用拟时序分析(pseudotime analysis),将所有细胞定位在一条动态的拟时序轨迹上,以高分辨率重建了GTs和ECs发育进程(图4a)。结果显示,主要由ECs组成的分支被定义为“前分支”(pre-branch),并在轨迹中识别出一个关键分化节点(node 1),该节点将细胞分为三种状态:State 1(ECs主导)、State 2(ECs与GTs过渡态和State 3(GTs富集),揭示了腺毛发育的动态过程(图4a-c)。其中,腺毛标记基因的转录积累模式沿拟时序轨迹映射,表明其主要在轨迹末端(State 3)高表达(图4d)。此外,总计106个拟时序依赖基因(PDGs)从分化轨迹中被鉴定,它们涉及多个转录因子家族(图4f),其可能与GTs发育相关。若再进一步划分,则可将PDGs分成三个模块(图4e),均富集于“次生代谢过程”,且“模块1”(含最多PDGs)进一步富集于生物合成、脂质结合、细胞生长及DNA结合TF活性,与现有的腺毛发育受复杂转录网络调控研究一致。最终,12个可能参与腺毛发育调控的候选基因被筛选(图4g),主要涉及HD-ZIP家族,MYB家族、bHLH家族、WRKY家族等。这些发现表明,艾草GTs的发育受多个保守TF家族构成的复杂转录网络调控。
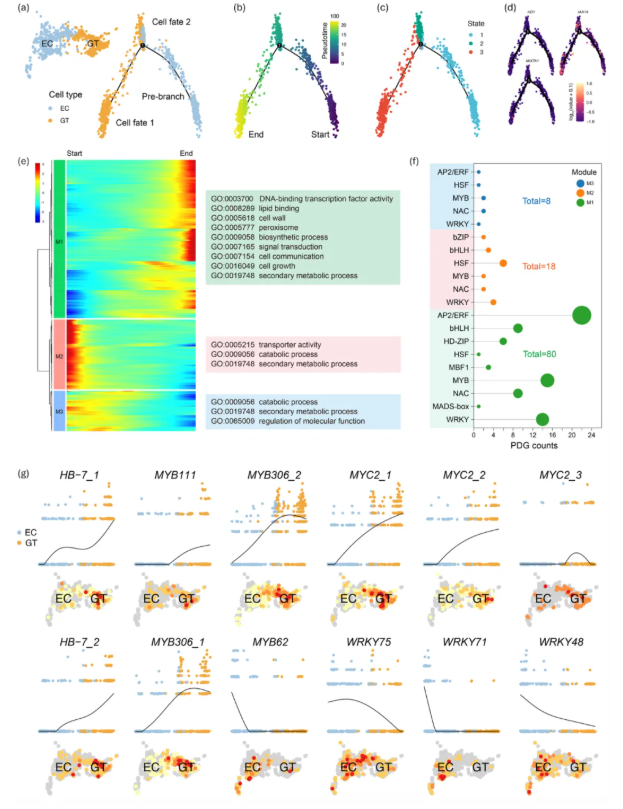
图4 艾草GT发育的拟时序轨迹分析
05艾草GTs细胞类型特异性的倍半萜生物合成
根据上述代谢组分析可知,艾草GTs中富含结构多样的倍半萜类化合物(图1e-f)。其中,功能重要的倍半萜在GTs中显著积累(图5a)。为解析倍萜生物合成的细胞类型特异性,MVA途径相关基因的单细胞表达模式首先被解析。结果显示,TPS-a亚家族的一组关键倍萜合成基因在不同细胞类型中表现出差异化的表达谱(图5b)。为明确这些基因与不同细胞群体间的关联,基于艾草叶片的单细胞图谱构建的MVA途径基因与TPS基因的共表达网络,总计9个上游途径基因和7个TPS基因被成功捕获(图5c)。结合系统发育树,这些TPS基因被分成两个明显的分支(图5d)。其中,第一分支与单萜生物合成相关,另一分支则与倍萜生物合成活性相关。基于上述聚类结果,推测并成功验证出:AarTPS52为β-法呢烯合酶(图5e);AarTPS77为β-石竹烯合酶,主要产物为β-石竹烯(图5f);AarTPS95和AarTPS96主要负责合成胚芽烯A及其热解产物β-榄香烯(图5g)。为预测调控GTs的形成与萜类合成相关的潜在转录因子,进一步对AarTPS52、AarTPS77、AarTPS95和AarTPS96基因转录起始位点上游2000 bp的启动子序列进行生物信息学分析(PlantCare数据库),总计51类顺式调控元件被鉴定,其中包括激素响应元件、胁迫响应元件及大量MYB/MYC结合位点(尤以AarTPS95和AarTPS77为著),暗示这些TPS可能受特定TFs调控,但其具体机制仍需进一步研究。
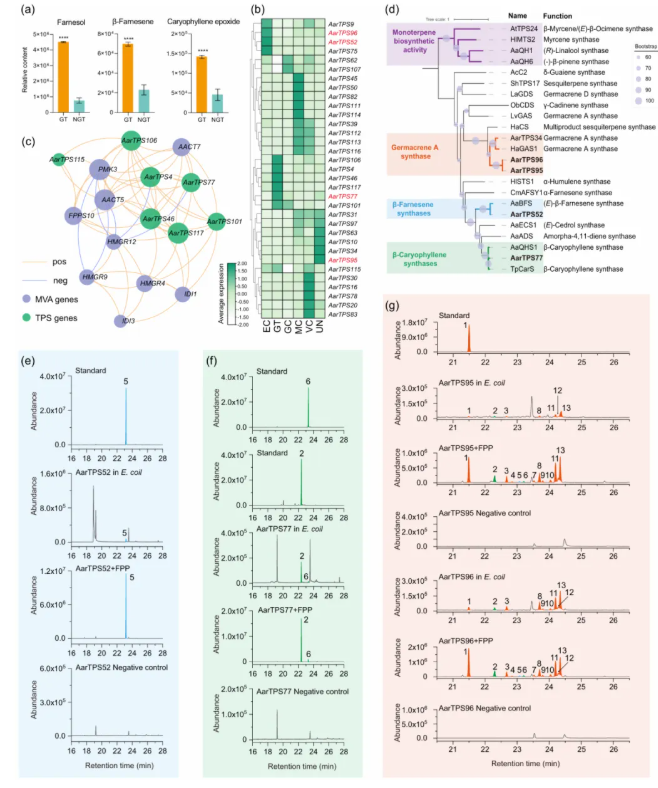
图5 艾草叶细胞类型特异性倍半萜的生物合成
本研究对艾草GTs进行了全面的代谢组学分析,揭示出GTs与NGTs间显著的代谢差异。尤为重要的是,单细胞转录组技术首次在艾草中被应用,系统解析了组织分化与次生代谢物生物合成的分子机制(图6)。研究内容主要如下:
1、通过液相色谱-质谱联用(LC-MS)和气相色谱-质谱联用(GC-MS),鉴定出GTs与NGTs间的969种DAMs,其中GTs显著富集萜类、黄酮类及脂肪酰类代谢物,尤以倍半萜类占比最高。
2、构建的艾草叶片单细胞转录组图谱,注释出MCs、ECs、VCs、GCs及GTs等细胞群。
3、揭示了GTs的连续发育轨迹,并筛选出调控GTs发育的关键候选TFs。
4、鉴定出β-石竹烯合成酶AarTPS77和β-法呢烯合酶AarTPS52,并发现AarTPS95和AarTPS96可催化生成胚芽烯A及12种倍半萜衍生物。总的来说,该研究为解析艾草GTs发育及次生代谢物积累机制提供了新见解,助力提升药材质量。
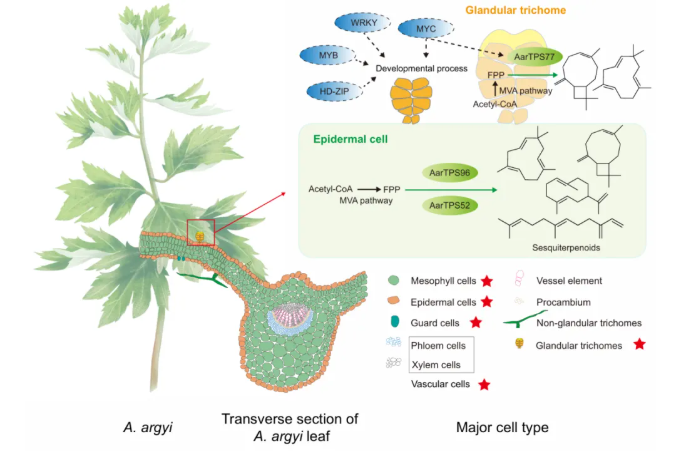
图6 艾草叶单细胞转录图谱示意图
单细胞转录组测序:是在单个细胞水平进行高通量测序的技术,能够有效解决细胞异质性,有助于发现新的稀有细胞类型,深入了解细胞生长过程中的表达调控机制。利用微流控系统通过序列标签(barcode和UMI)区别群体中的不同细胞和转录本,获得单细胞水平的基因表达谱。