文章标题:Veillonella intestinal colonization promotes C. difficile infection in Crohn’s disease
发表期刊:Cell Host & Microbe
影响因子:18.7
客户单位:上海交通大学医学院附属仁济医院
百趣提供服务:新一代代谢组学NGM 2 Pro
研究背景
克罗恩病是一种常见的炎症性肠病(Inflammatory Bowel Disease, IBD)。临床表现包括腹痛、腹泻、肠梗阻等。它与 IBD 的另一种主要类型溃疡性结肠炎不同,通常影响整个消化道,引起间歇性而不是持续性炎症。除了手术切除受影响的肠道部分外,没有其他治疗方法,术后复发很常见。
虽然肠道菌群失调是包括克罗恩病在内的 IBD 的一个关键特征,但 IBD 和克罗恩病中宿主-微生物群相互作用的机制才刚刚开始被揭示,并且主要集中在免疫反应上。
特定微生物如何影响 IBD 环境中的其他微生物,进而导致 IBD 或感染,在很大程度上仍然未知。肠道菌群失调通常由抗生素治疗引起,已知是艰难梭菌感染(Clostridioides difficile Infection, CDI)的主要风险因素,CDI 是发达国家最致命的抗菌素耐药性相关疾病。
研究结果
01-韦荣球菌与克罗恩病患者 CDI 的发生和严重程度有关
为了研究克罗恩病患者肠道微生物群与 CDI 发展之间的潜在关系,作者首先分析了公开可用的宏基因组数据。在该分析中,作者纳入了 17 例 CDI 合并 IBD 患者和 224 例 IBD 对照患者的数据(而不仅仅是克罗恩病),因为克罗恩病期间 CDI 相关数据的可获得性较低。
结果显示,两组菌群的 α-多样性和 β-多样性均存在显著差异,其中 IBD+CDI 组中富集最显著的物种是两种 Veillonella 属细菌 ——V. parvula(小韦荣氏球菌)和 V. dispar(殊异韦荣氏球菌)(图 1C)。韦荣氏球菌属的成员是口腔共生菌,偶尔参与口腔疾病,其肠道异位定植可能参与肠道炎症进程,且先前在微生物组研究中已被证实与 IBD、克罗恩病和溃疡性结肠炎相关。
随后,作者对 88 例克罗恩病患者进行了前瞻性观察研究,其中 35 例患有 CDI(图 1D)。结果显示,Veillonella 的相对丰度与表示疾病严重程度的克罗恩病活动指数(CDAI)存在显著正相关(图 1H)。
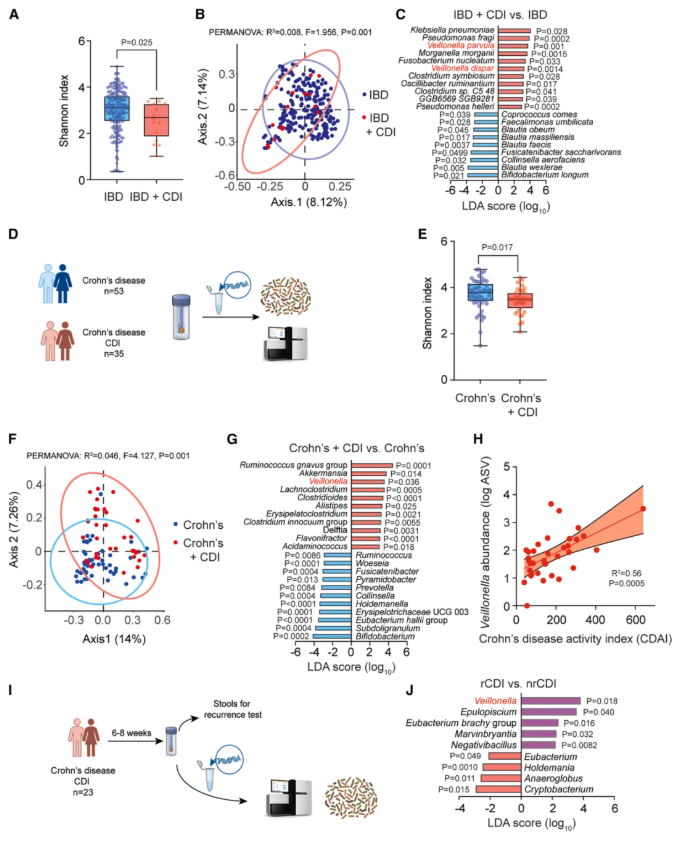
图1. 韦荣氏球菌与克罗恩病患者艰难梭菌感染(CDI)的发生及严重程度相关
02-小韦荣氏球菌(V. parvula)加重结肠炎模型中 CDI 的严重程度
作者采用 DSS/TNBS 诱导的结肠炎小鼠模型(图 2A),同时设置非结肠炎对照模型,并以大肠杆菌、脆弱拟杆菌为对照以验证作用特异性,借助 qPCR、组织学分析等技术检测相关指标。
结果显示,V. parvula 仅在肠道炎症背景下发挥作用:在非结肠炎模型中,既无法诱导 CDI 发生,也不能升高疾病评分;而在结肠炎模型中,V. parvula 经灌胃后肠道定植量显著增加(图 2B),不仅能通过升高粪便艰难梭菌 CFU 数量、提高疾病活动指数(DAI)评分以加重 CDI 发病进程(图 2C-E),还可诱导肠道组织中肿瘤坏死因子 α(TNF-α)、白细胞介素-1β(IL-1β)的基因表达(图 2F-G)及 TNF-α 蛋白水平升高(图 2H),进而加剧肠上皮损伤,表现为炎症细胞浸润增多、杯状细胞丢失、隐窝脓肿等病理改变(图 2I)。
该促 CDI 及炎症效应具有 V. parvula 特异性,大肠杆菌、脆弱拟杆菌均无此作用(图 2J-O);此外,V. parvula 在抗生素治疗后仍保持较强的肠道定植持久性(图 2Q),可显著增加 CDI 复发(rCDI)风险(图 2R-S)。
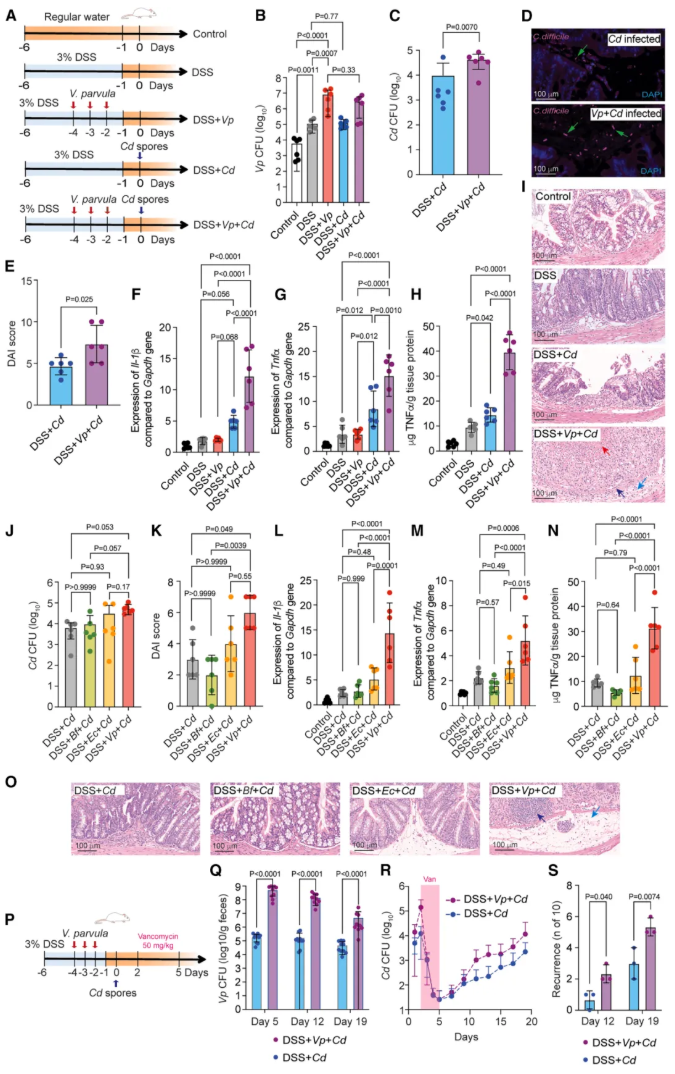
图2. 在肠道炎症动物模型中,小韦荣球菌增加 CDI 的严重程度
03-小韦荣球菌刺激艰难梭菌在小鼠发炎的肠道中萌发
在 DSS/TNBS 诱导的结肠炎小鼠模型中(非炎症模型无此生物学效应),作者采用双荧光标记追踪体系:以异硫氰酸荧光素(FITC)特异性标记艰难梭菌休眠孢子,以 Cy5ADA 染料靶向染色萌发后具有代谢活性的艰难梭菌营养细胞。结合流式细胞术定量分析与共聚焦显微镜可视化观察盲肠内容物,结果显示,V. Parvula 定植组的艰难梭菌孢子萌发率显著升高(图 3A-C)。
该萌发促进效应具有 V. parvula 特异性,大肠杆菌、脆弱拟杆菌对照组未观察到类似表型(图 3D-E);体外功能验证进一步证实,V. parvula 定植小鼠的盲肠内容物及克罗恩病合并 CDI 患者的粪便样本,均能显著增强艰难梭菌孢子的体外萌发能力(图 3F-G)。机制上,该效应通过 V. parvula 介导的肠道内胆汁酸积累实现,进而增加克罗恩病患者 CDI 的发生风险。
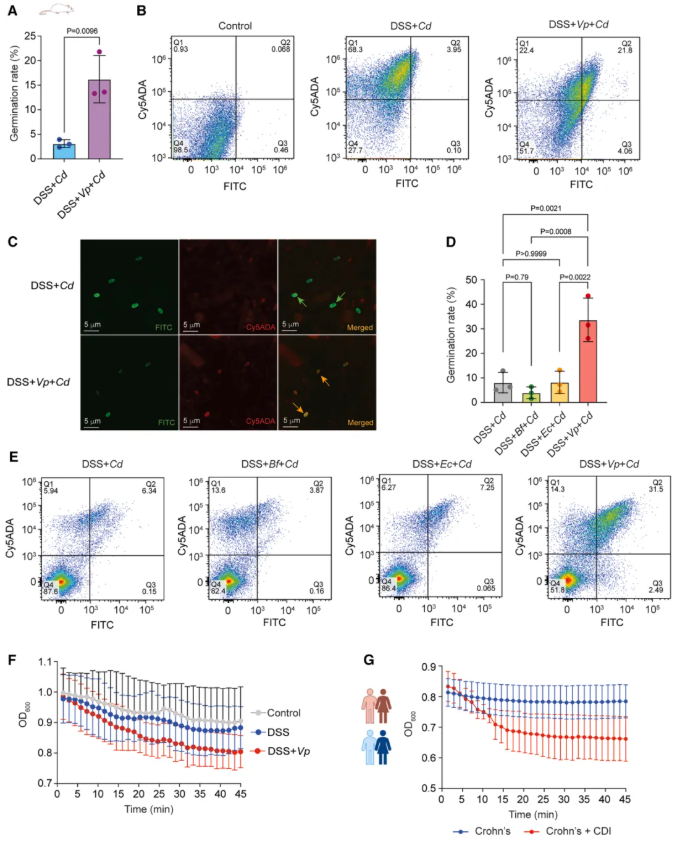
图3. 小韦荣球菌刺激艰难梭菌在小鼠发炎的肠道内萌发
04-在克罗恩病患者和小鼠结肠炎模型中,韦荣球菌与胆汁酸代谢和浓度增加有关
为阐明 CDI 相关肠道微生物组促进克罗恩病患者艰难梭菌萌发的潜在机制,作者对 22 例克罗恩病患者、25 例克罗恩病合并 CDI 患者的粪便样本进行代谢组学分析。结果显示,两组差异最显著的代谢物为胆汁酸(含胆酸、牛磺结合型胆汁酸等)(图 4C);通路富集分析中,胆汁分泌、原发性胆汁酸生物合成通路显著富集(图 4D);Spearman 相关性分析证实,韦荣球菌丰度与多种胆汁酸的含量呈显著正相关(图 4E)。
为验证上述关联,作者构建小鼠 DSS 结肠炎模型,对盲肠内容物进行代谢组学检测。结果显示,小韦荣球菌(V. parvula)接种组与对照组代谢组存在显著差异(图 4F-G),其中多种胆汁酸水平升高最显著;通路分析可见,初级胆汁酸合成、胆汁分泌及牛磺酸 / 次牛磺酸代谢通路均显著上调(图 4I),与临床患者样本的代谢组变化高度一致(图 4C-E)。
机制上,韦荣球菌通过抑制肠道胆汁酸转运蛋白 ASBT 的表达,减少胆汁酸再吸收,导致肠道内胆汁酸异常积聚,进而为艰难梭菌萌发提供必要信号。
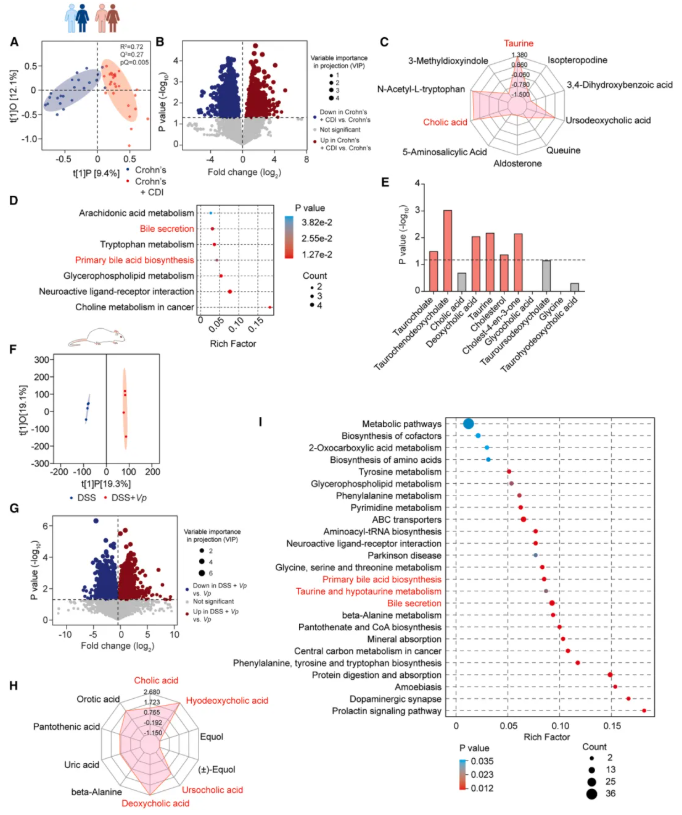
图4. Veillonella 与克罗恩病患者和小鼠结肠炎模型中胆汁酸代谢和浓度增加有关
05-V.parvula抑制负责回肠胆汁酸重吸收的主要转运蛋白的表达
作者先假设 V. parvula 通过促进胆汁酸合成增加肠道胆汁酸浓度,但实验显示:DSS 模型小鼠肝组织中胆汁酸合成相关酶的核心编码基因未被显著上调,TNBS 模型中仅 2 个相关基因表达略高,该假设未成立。
随后提出核心假设:V. parvula 通过抑制胆汁酸重吸收发挥作用(胆汁酸重吸收主要依赖回肠的根尖钠依赖性胆汁酸转运体 ASBT,其功能在克罗恩病患者中已降低)。
验证实验证实:V. parvula 在小鼠结肠炎模型的回肠中富集(图 5A-B),且诱导回肠组织炎症(图 5C);V. parvula 显著增加肠道内总胆汁酸及共轭型胆汁酸(如牛磺胆酸 TCA)浓度(图 5D-F),荧光标记 TCA 排泄实验证实其重吸收受阻(图 5J);RT-qPCR 和免疫组化检测显示,V. parvula 显著抑制回肠组织中 ASBT 的基因和蛋白表达(图 5K-L)。综上,V. parvula 通过抑制 ASBT 表达,损害回肠对胆汁酸的重吸收,导致盲肠胆汁酸积聚,进而促进艰难梭菌孢子萌发。
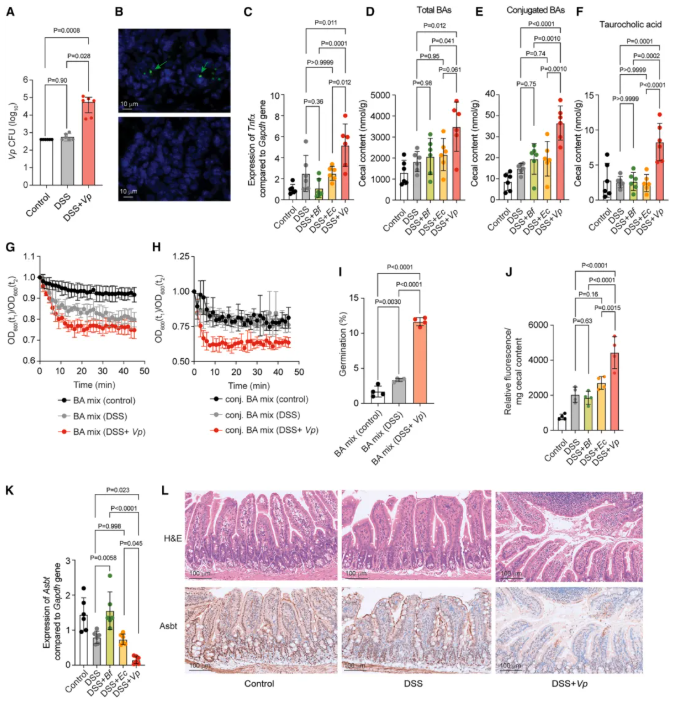
图5. V. parvula 抑制负责回肠胆汁酸重吸收的主要转运蛋白的表达
06-V.parvula诱导炎症信号通路和 c-Jun/c-Fos 表达
为阐明 V. parvula 抑制 ASBT 的分子机制,作者以分化后可形成肠上皮样单层结构的 Caco-2 细胞系为模型,通过全基因组 RNA 测序、RT-qPCR 及 western blot 等技术,探究 V. parvula 对细胞基因表达的影响。
全基因组分析表明,V. parvula 处理后,炎症相关基因及信号通路显著上调(图 6A-B),同时 ASBT 基因和蛋白表达水平显著降低(图 6C-D);炎症细胞因子 TNF-α 的基因表达显著升高,证实细胞存在炎症激活(图 6E);c-Jun 和 c-Fos 基因表达显著上调(图 6F-G),二者共同构成 AP-1 早期反应转录因子,且已有研究证实 C-Fos 参与炎症诱导的 ASBT 表达调控。
综上,V. parvula 通过激活肠上皮细胞的炎症信号通路,上调 c-Jun/c-Fos 转录因子表达,进而介导 ASBT 表达抑制。
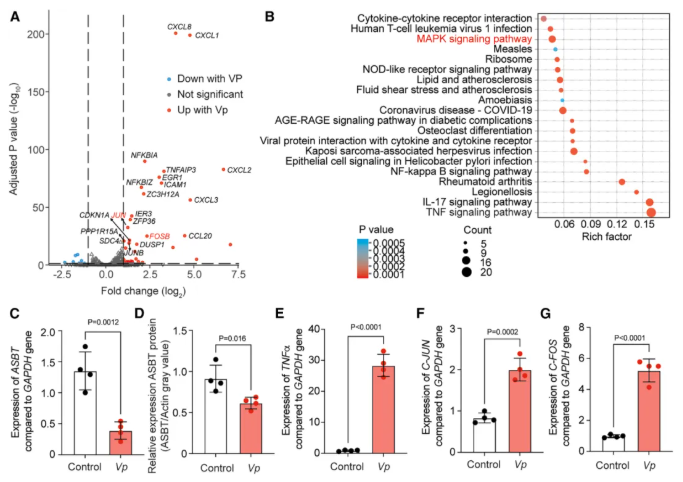
图6. V. parvula 诱导炎症信号通路和 c-Jun/c-Fos 表达
07-V.parvula LPS具有强烈的促炎特性,刺激 ASBT 调节信号通路
为阐明 V. parvula 介导 c-Fos/c-Jun 依赖的 ASBT 抑制的关键细菌因子,作者采用 Calatayud 等人开发的简化版回肠宿主-微生物组 transwell 模型(图 7A),将 Caco-2 肠上皮样细胞接种于上层小室、THP-1 巨噬细胞样细胞接种于下层小室,通过检测 ASBT、TNF-α 及 IL-1β 的表达,对比完整 V. parvula 与无细胞培养上清液的活性(图 7B-D)。
结果显示,完整细菌的活性显著高于上清液,提示核心活性分子为细菌表面相关分子——革兰氏阴性菌 V. parvula 的关键表面促炎分子为脂多糖(LPS)。
进一步分离 V. parvula 的 LPS,与脆弱拟杆菌(B. fragilis)、大肠杆菌的 LPS 对比分析:V. parvula LPS 可显著抑制 ASBT 表达,同时诱导 c-Fos、c-Jun、FOSB 及 IL-1β 表达,且能上调 TLR4 受体表达(图 7E-J);
Western blot 验证显示,V. parvula LPS 可激活 MEK/ERK 信号通路,促进 c-Fos、c-Jun 磷酸化(图 7K),进而抑制 ASBT 表达并减少牛磺胆酸(TCA)的跨上皮转运(图 7L)。
加入 c-Fos/AP-1 特异性抑制剂(T5224)后,V. parvula LPS 对 ASBT 转录及蛋白水平的抑制效应显著减弱(图 7M-N),证实该调控依赖 c-Fos 介导的信号通路。
鉴于 V. parvula 的肠道异位定植依赖硝酸盐代谢能力,作者探究其对细菌功能的影响:V. parvula 可高效将硝酸盐代谢为亚硝酸盐(大肠杆菌该能力较弱,脆弱拟杆菌无此能力,图 7O);脆弱拟杆菌的基础粘附能力最强,但硝酸盐可显著增强 V. parvula 对肠上皮细胞的粘附能力(图 7P),进而促进其定植及 LPS 介导的 ASBT 抑制效应。
综上,V. parvula 通过 “LPS 介导的促炎信号通路激活” 与 “硝酸盐增强的肠道粘附定植能力” 协同作用,最终抑制 ASBT 表达,减少胆汁酸重吸收。
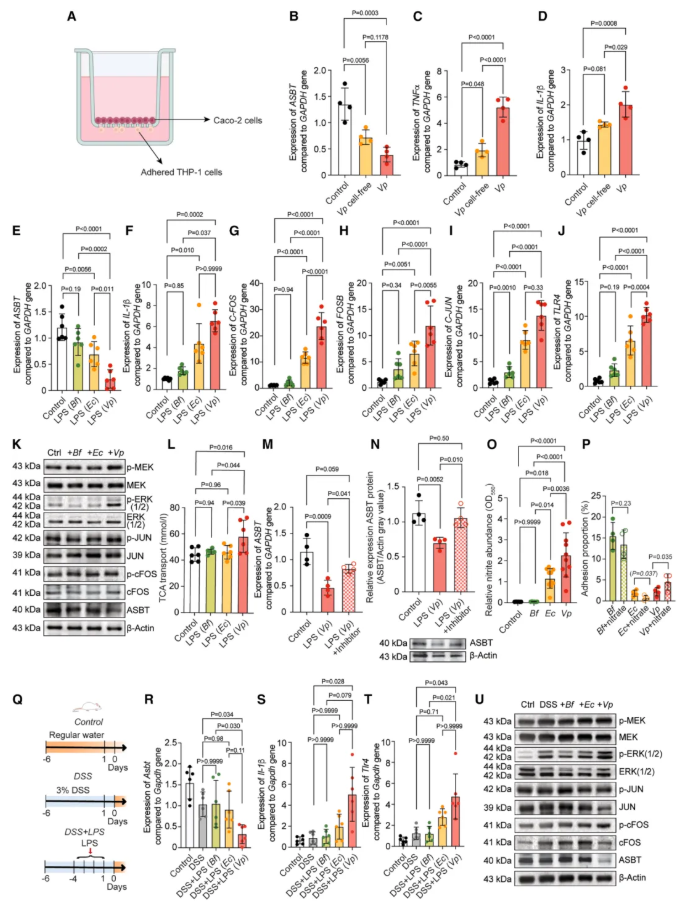
图7. V. parvula LPS 具有强烈的促炎特性,可刺激 ASBT 调节信号通路
研究总结
本研究阐明克罗恩病与 CDI 的关联机制:小韦荣球菌(V. parvula)肠道定植与克罗恩病患者 CDI 发生、严重程度及复发密切相关。其通过表面 LPS 激活 TLR4-MEK/ERK 通路,诱导 c-Jun/c-Fos 表达,抑制胆汁酸转运蛋白 ASBT,导致肠腔胆汁酸(如 TCA)积聚,进而促进艰难梭菌孢子萌发,最终加剧 CDI。
百趣生物新一代代谢组学 NGM 2 Pro,凭借全球领先的2w+代谢物标准品自建库,显著改善代谢组学鉴定准确性不足、数量有限的痛点。其基于LC-MS技术,可检测生物受刺激后小分子代谢物动态变化,助力筛选差异代谢物并关联生理病理。针对代谢物多样性及提取局限,该技术通过多色谱柱联用覆盖非极性/极性代谢物与脂质,结合标准品自建库进一步提升鉴定效率,为标志物筛选、机制研究提供有力支撑。