
英文标题:Phosphoproteomics delineates hepatocellular carcinoma subtypes and pinpoints therapeutic targets
中文标题:磷酸化蛋白质组学揭示肝细胞癌亚型及治疗靶点
发表期刊:Hepatology
影响因子:15.8
肝细胞癌(Hepatocellular carcinoma,HCC)作为最常见的原发性肝恶性肿瘤,常发生于慢性肝病患者。由于症状隐匿且多数患者确诊时已至晚期,系统治疗成为主要手段,但疗效持久性仍显著不足。
蛋白质磷酸化作为细胞信号转导的核心环节,其调控异常与 HCC 信号网络病理改变密切相关。尽管近年多项基于质谱的 HCC 蛋白质组学研究揭示了胆固醇代谢、微环境失调、免疫状态等关键特征,但受限于磷酸化蛋白动态分布复杂性、丰度范围广及生物信息学分析技术瓶颈,尚未有研究从磷酸化蛋白质组学角度对 HCC 进行亚型分类和精准治疗靶点挖掘。
本研究通过全面磷酸化蛋白质组学分析,首次利用无监督聚类识别出与患者预后显著相关的 3 个 HCC 亚型,并结合激酶富集分析揭示了潜在治疗靶点,为 HCC 的分型诊断和靶向治疗提供了新路径。
图形摘要
研究结果
从 64 例未接受过系统治疗或放疗的 HCC 患者中,采集肿瘤及非肿瘤肝组织(Nontumor liver tissue,NAT)样本,经磷酸化蛋白质组学分析,共发现 2,186 个差异磷酸化位点。
基于这些位点,通过无监督聚类,可将 62 例 HCC 分为 A、B、C 三个亚型(图1A-B),其总生存期(OS)和无复发生存期(RFS)依次递减(图1C-D),表明磷蛋白亚型具有独立预后价值。
其中,亚型 C 患者血清甲胎蛋白比例显著高于 A、B 亚型(图1E),BCLC 中晚期(B/C期)占比随亚型 A→C 递增(图1F),且肿瘤血栓发生率和瘤体大小在 C 亚型中更高。
亚型特异性分析显示:
① C 亚型:富集于细胞增殖和RNA剪接通路,Ki-67 阳性细胞比例达70%(图1I-K);
② A 亚型:以细胞骨架和糖代谢相关磷酸化蛋白为主,Ki-67 阳性率仅 10%(图1K);
③ B 亚型:兼具 A/C 部分特征,表现为中度 RNA 剪接通路活化和凋亡相关磷酸化。
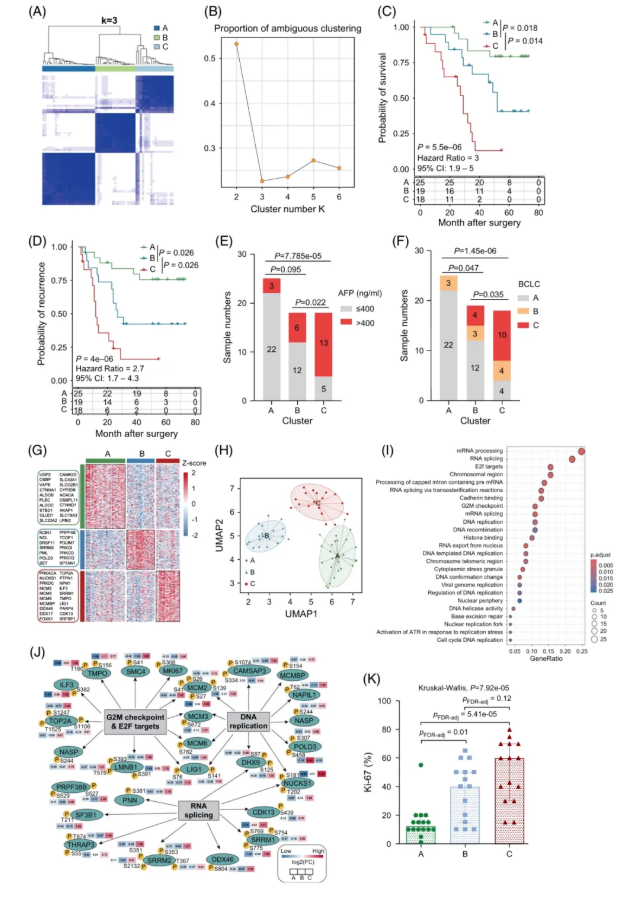
图1. HCC 磷酸化蛋白亚型及其与临床病理特征的关系
基于早期 HCC 队列和 CHCC-HBV 队列的蛋白质组学研究,采取相同的数据筛选标准和处理方法,对这两外部队列的磷蛋白组学数据进行分析。
结果发现,早期 HCC 队列中共享 394 个亚型特异性磷酸化位点,CHCC-HBV 队列中共享 194 个亚型特异性磷酸化位点。若基于这些共享磷酸化位点,透过有监督的层级聚类,可将患者重新划分为 3 个亚型(图2A)。
此外,在 UMAP 分析中,共享的亚型特异性磷酸化位点亦能清晰区分 3 个亚型(图2B)。同样地,在这两外部队列中,磷酸化蛋白亚型 A、B、C 的 OS 和 RFS 均呈现显著差异(图2C)。若将磷酸化蛋白亚型与既往的蛋白质组学亚型进行对比,可以发现,患者在两个分类系统中的分布存在明显差异(图2D)。
在早期 HCC 队列中,磷酸化蛋白亚型在 OS 和 RFS 的分层上均优于蛋白质组学亚型(图2E-F)。同样地,在 CHCC-HBV 队列中,磷酸化蛋白亚型在 OS 和 RFS 的分层上亦优于蛋白质组学亚型。结合差异分析可知,在 B 和 C 亚型中,磷酸化蛋白组学水平与 A 亚型存在显著差异(图2G-H),而蛋白质组学亚型在磷酸化位点表达上并无差异。
此外,蛋白表达分析,B 或 C 亚型中异常磷酸化位点对应的蛋白在不一致亚型患者中差异更显著(图2I),表明磷酸化蛋白聚类对生物功能的捕捉更敏感。综上,磷酸化蛋白组学亚型更能精准分层 HCC 患者,其预后价值可超越传统分类。
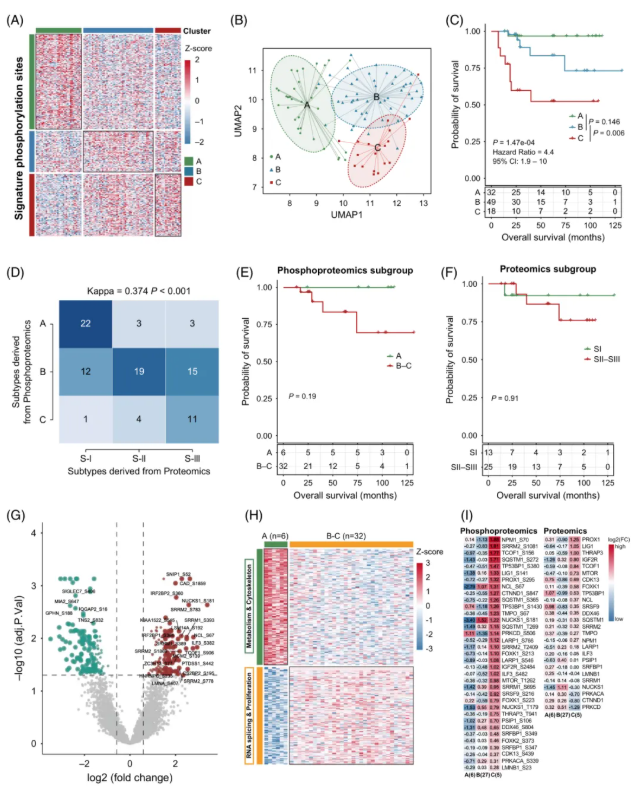
图2. nature 报道的队列研究表明,早期 HCC 的磷酸化蛋白组学亚型分型相较于蛋白质组学亚型分型具有更优的预后价值
鉴于 C 亚型患者预后最差,为探索针对该亚型的特异性治疗策略,显著高表达的 103 种蛋白被筛选分析。在 Reactome 通路富集中,C 亚型的前三大富集通路依次为免疫系统、细胞周期和 RNA 代谢(图3A)。
透过蛋白互作网络,可将这 103 个蛋白可聚类为 4 个功能模块:细胞增殖、免疫调控、RNA 加工及 RNA 剪接(图3B)。进一步联合 DrugBank 数据库中的药物信息筛选潜在靶点,最终锁定 17 个作为候选药物靶点(图3C)。若再结合前三类富集模块的核心调控蛋白,则可筛选出 3 个关键蛋白:RAE1、CDK7 和 SRC(图3D)。其中,这三者的高表达与早期 HCC 队列(图3E)及 CHCC-HBV 队列(图3F)患者的不良预后显著相关。
然而,目前仅 SRC 具有 FDA 批准药物。因此,SRC 可作为 C 亚型 HCC 患者的潜在药物靶点。
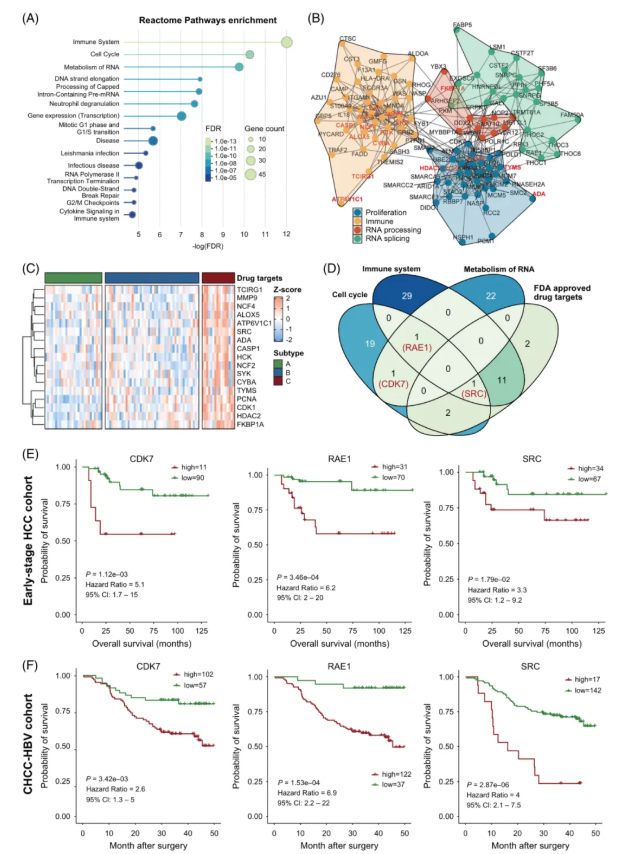
图3. 蛋白质组学筛选 C 亚型肝癌潜在药物靶点 SRC
在现有结果中,与 NAT 相比,所有亚型的肿瘤样本均表现出增殖特征,如细胞周期相关激酶的显著激活。为探究各亚型的激酶特性,对差异磷酸化位点进行激酶预测分析。
结果显示,与 A/B 亚型相比,C 亚型中增殖相关激酶的活性最高,B 亚型次之,A 亚型最低(图4A-C)。这一发现与各亚型中 Ki-67 阳性细胞比例一致。
对上调激酶的调控网络进一步分析,结果显示,在 HCC 磷蛋白亚型 C 中,与细胞周期和染色质重塑相关的磷酸化底物显著增加(图4D)。此外,C 亚型中高活性激酶主要富集于细胞衰老、TP53 调控、细胞周期及免疫检查点表达通路(图4E)。结合 PPI 网络,可将这些激酶聚类为 3 组,且 MTOR、PRKDC 和 CDK2 是这 3 组的关键连接节点(图4F)。
通过独立临床样本的免疫印迹实验验证,C 亚型肿瘤中 CDK1/2 的表达及其磷酸化激活状态显著高于 NAT 及其他亚型(图5A-D)。同样地,免疫组化分析也显示,C 亚型肿瘤的 CDK1-T161/CDK2-T160 染色强度显著高于 A/B 亚型(图5E-F)。
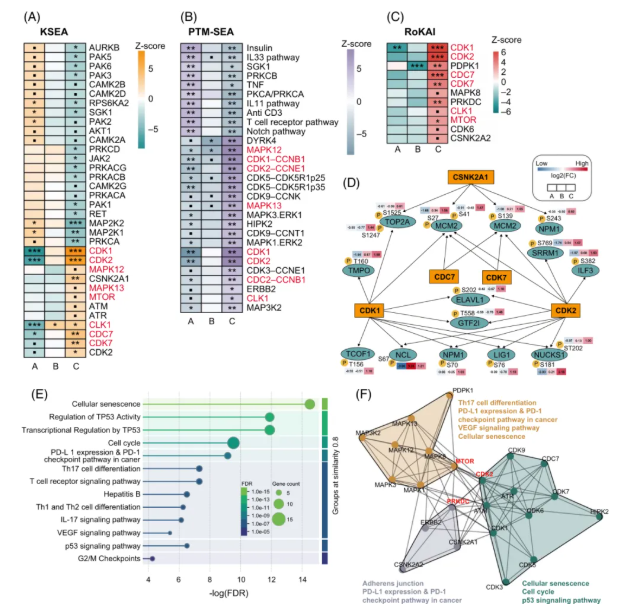
图4. 磷酸化蛋白组学分析精准预测 HCC 的 A、B、C亚 型中激酶 CDK1 和 CDK2 的活性呈现逐渐显著增加的趋势
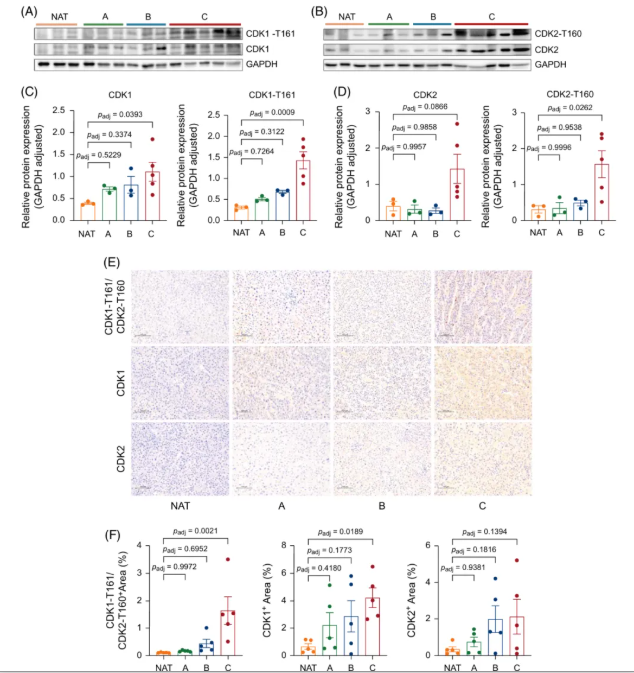
图5. Western 印迹和免疫组织化学染色结果证实 CDK1 和 CDK2 在 C 亚型肝细胞癌中活性最高
为验证 SRC 抑制剂 Bosutinib 对不同磷酸化蛋白组学亚型 HCC 的疗效,首先,两种 HCC 来源细胞系(SNU449、Huh7)及一种肝母细胞瘤来源细胞系(HepG2)被用于磷酸化蛋白组学分析。经数据标准化,可获得 3 种细胞系共 260 个亚型特异性磷酸化位点。
基于这些位点的层次聚类分析(图6A)及 NTP/PAM 分型方法,可将 SNU449、HepG2、Huh7 分别归类为磷蛋白组学 A、B、C 亚型(图6B-C),且其增殖潜能呈递增趋势。
透过 INKA 分析可知,CDK1 和 CDK2 在 3 种细胞系中均被激活,其中 C 亚型(Huh7)的 CDK1 活性最高,B 亚型(HepG2)的 CDK2 活性最强(图6D-F)。
同样地,“激酶-底物”网络分析亦表明 CDK1/2 在所有细胞系的失调网络中占据核心地位。
此外,Bosutinib 的剂量效应曲线显示,B 亚型(HepG2)和 C 亚型(Huh7)的 IC50 值分别为 2.875 μM和 3.209 μM,仅为 A 亚型的 1/8 和 1/7(图6G-I),表明 B/C 亚型对 Bosutinib 敏感性显著高于 A 亚型。
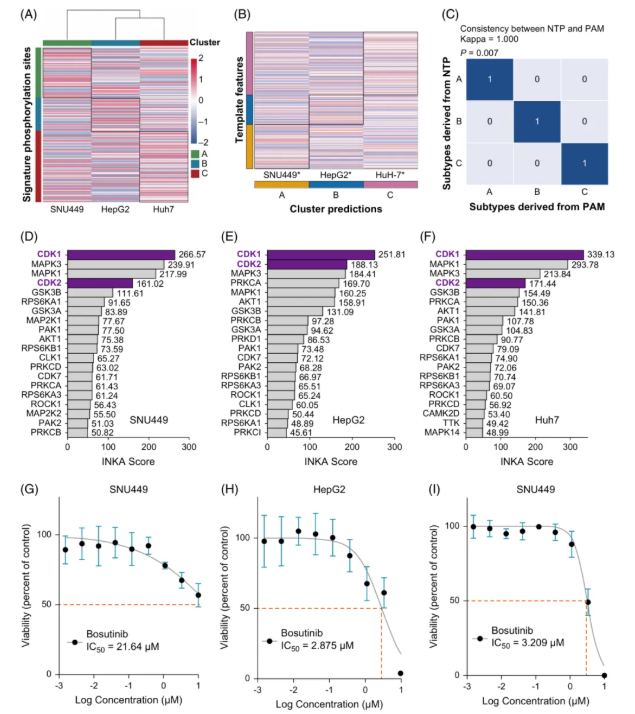
图6. 肝癌细胞系对 Bosutinib 的敏感性与 A、B、C 三种亚型的磷酸化蛋白组学亚型中观察到的异常的激酶活性变化有关
为探究 Bosutinib 对真实 HCC 患者的治疗潜力,4 例 HCC 患者来源的异种移植(PDX)模型被构建。经数据标准化,总计 311 个亚型特异性磷酸化位点被鉴定。
基于这些位点的层次聚类分析(图7A)及 NTP/PAM 分型方法,将 PDX-2/4、PDX-3/1 分别归类为磷蛋白组学 A、B、C 亚型(图7B-C)。通过整合人类分泌蛋白数据库及 PDX 蛋白质组数据,筛选出 53 种亚型特异性分泌蛋白标志物,其分型准确率达 75%。
INKA 分析显示,PDX 模型中 CDK1/2 活性与肿瘤恶性程度正相关:C 亚型(PDX-3/1)CDK1 活性最高,而 CDK2 活性随亚型恶性递增(图7D-G)。“激酶-底物”网络分析进一步证实 CDK1/2 在 PDX 失调网络中占据核心地位。
另外,口服 Bosutinib 治疗结果显示,其对 B 亚型(PDX-4)和 C 亚型(PDX-3/1)肿瘤生长抑制显著,而对 A 亚型(PDX-2)效果较弱(图7H-K)。免疫组化分析表明,B/C 亚型肿瘤中 CD31(血管标志物)表达显著高于 A 亚型,且 Bosutinib 治疗后 CD31 下调;PD-L1 在所有亚型中均阴性。
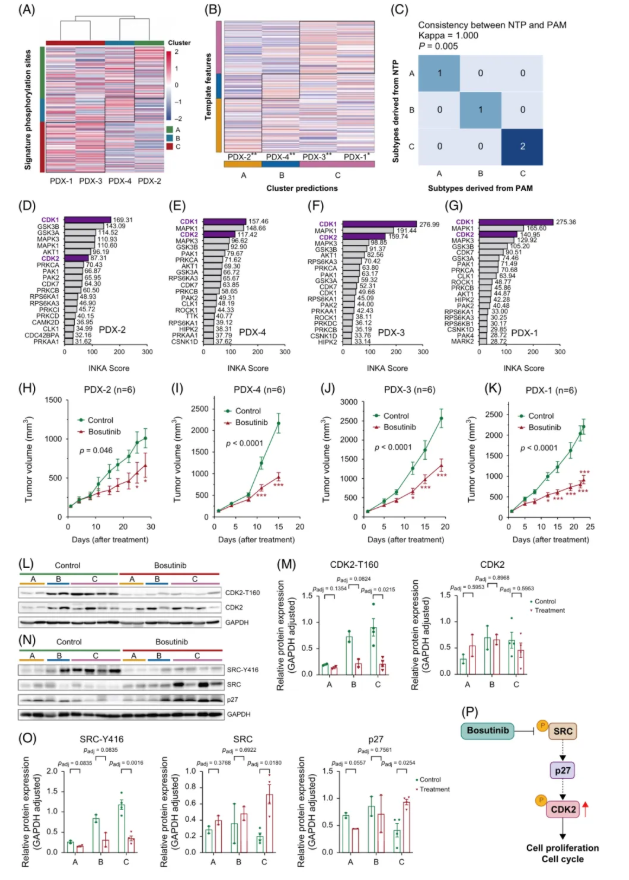
图7. CDK2 和 SRC 激酶活性在 B 和 C 亚型的肝癌 PDX 模型中表达异常,并被 Bosutinib 特异性抑制
研究小结
本研究使用磷酸化蛋白质组队列数据来对肝细胞癌患者进行分类,并确定了 3 种新的磷酸化蛋白亚型。
与以前发表的肝细胞癌蛋白质组图谱相比,基于磷酸化蛋白质组学的分类在肝细胞癌患者的预后分层和生物学功能描述方面均显示出非凡的敏感性和重要性。
此外,它还揭示了肝细胞癌中改变的关键过程和蛋白激酶。靶向 SRC 和 CDK2 有望成为治疗 B 或 C 亚型肝细胞癌的有效方法。
磷酸化修饰蛋白组学:蛋白质磷酸化是由蛋白质激酶催化的把ATP的磷酸基转移到底物蛋白质氨基酸残基(Ser, Thr, Tyr)上的过程,是生物体内一种普通的调节方式,细胞内有超过30%的蛋白质发生磷酸化修饰,在细胞信号转导、调控细胞增殖、发育、分化、凋亡过程中起重要作用。蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍,也是最重要的机制。