
发表期刊:Journal of Hazardous Materials
影响因子:13.6
组学平台:TMT定量蛋白质组学+代谢组学
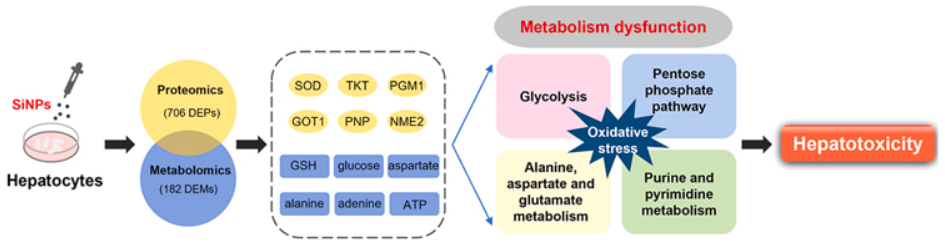
二氧化硅纳米颗粒(Silica nanoparticles, SiNPs)由于其独特的物理和化学性质,已广泛应用于工业制造、化妆品、食品和医疗行业。SiNPs源自人工材料和自然环境,通过各种暴露途径对人类健康产生有害影响。SiNPs污染导致大鼠脂代谢紊乱,其特征是生化参数水平异常。此外,SiNPs诱导的能量代谢功能障碍引起细胞溶血作用。然而SiNPs污染的代谢影响及其潜在机制在很大程度上仍不清楚。本研究通过TMT定量蛋白质组学和代谢组学方法探讨SiNPs污染对L-02肝细胞代谢过程的影响,为评价SiNPs的安全性提供科学依据。
基于SiNPs进行表征分析。TEM图像显示,所有颗粒呈近球形,分散良好(图1 A)。使用ImageJ软件计算颗粒的平均尺寸,尺寸分布直方图显示SiNPs的平均直径约为58 nm(图1 B)。本实验所用的SiNPs在蒸馏水和DMEM介质中均具有良好的稳定性和单分散性。
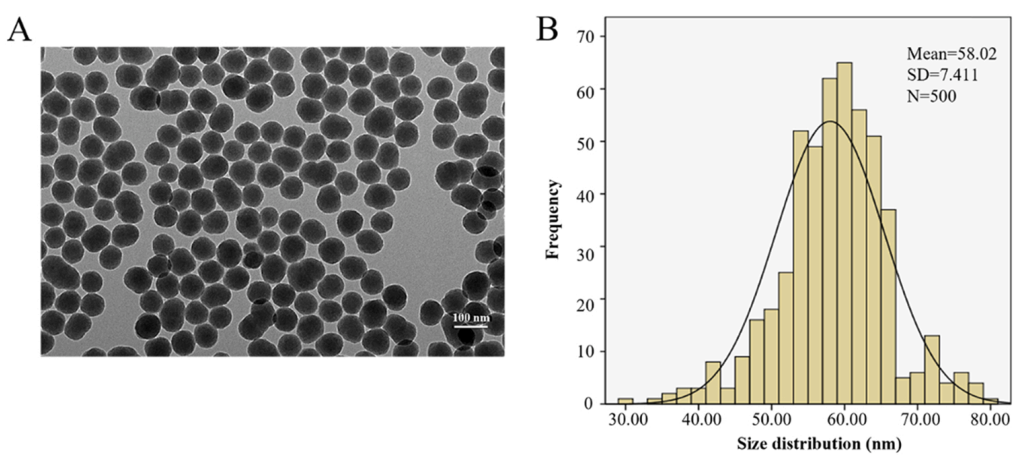
图1. SiNPs的表征
L-02细胞暴露于SiNPs后,通过光学显微镜观察细胞形态。如图2 A所示,随着处理剂量的增加,细胞开始萎缩,细胞间连接受损,部分细胞死亡。此外,通过TEM成像观察到颗粒物进入到L-02细胞中(图2 B)。TEM图像还显示内部的SiNPs主要聚集在溶酶体中。然后用CCK-8法测定SiNPs诱导的细胞毒性。结果表明,SiNPs呈剂量依赖性地抑制细胞活性,且细胞存活率在25 μg/mL及更高剂量下显著降低(图2 C)。在L-02细胞中,SiNPs的最低毒性剂量为25 μg/mL,因此,选择12.5、25和50 μg/mL的SiNPs分别作为低(L)、中(M)和高(H)剂量来进行后续的实验处理。
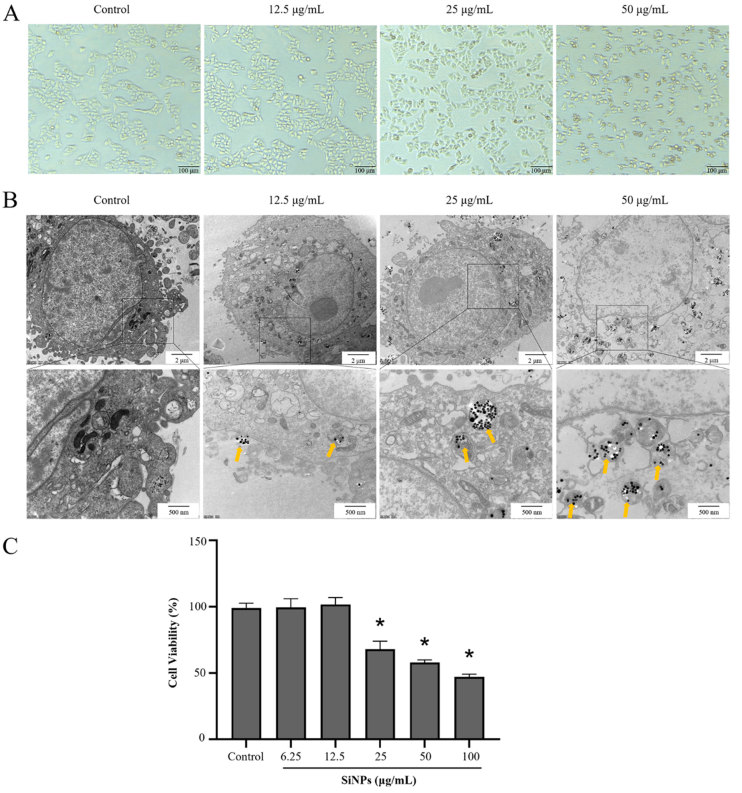
图2. SiNPs的细胞摄取和细胞毒性
为了确定SiNPs暴露对L- 02细胞蛋白质组学特征的影响,对SiNPs处理下的细胞进行了TMT定量蛋白质组学分析。根据生物信息学分析,共鉴定出4318个可信蛋白。与未处理的对照细胞相比,SiNPs诱导L-02细胞中蛋白表达的显著改变。火山图显示了差异表达蛋白(Differentially Expressed Proteins, DEPs)的总体分布情况,低剂量(12.5 μg/mL)SiNPs处理对蛋白质表达影响不大,中、高剂量(25和50 μg/mL)处理组蛋白质表达谱显著改变(图3 C)。考虑到中剂量组(25 μg/mL)的蛋白质表达和细胞存活率显著变化,后续分析将重点关注中剂量25 μg/mL的SiNP处理以研究其在肝细胞中的毒性。基于GO数据库对鉴定出的DEPs进行分类和富集。数据表明,SiNPs处理导致改变的蛋白在分子功能方面差异显著(图4 A)。此外,基于KEGG数据库的pathway富集分析表明,鉴定的DEPs在核糖体、碳代谢、戊糖磷酸途径、核糖核苷酸生物合成和氨基酸代谢中显著富集(图4 D)。通过PPI分析研究了蛋白质之间的复杂相互作用。由此产生的相互作用网络确定了几个密切相关的关键蛋白(图4 E)。这些结果表明,蛋白质合成异常、蛋白质错误折叠、氧化应激和代谢功能障碍可能参与了SiNPs诱导的肝毒性。
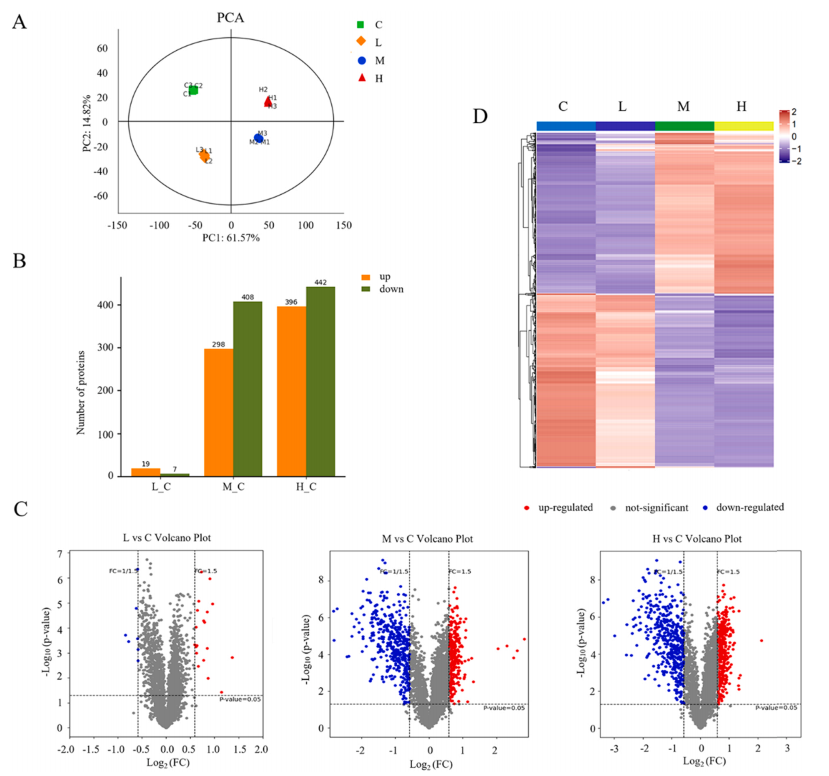
图3. 暴露于SiNPs的L-02细胞的蛋白质组学分析
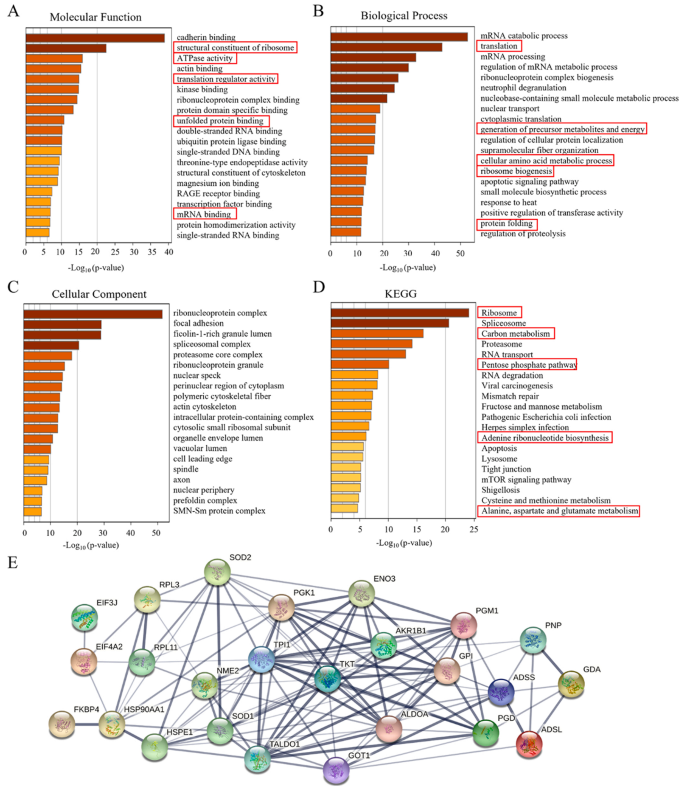
图4. 25 μg/mL SiNPs处理L-02细胞蛋白质组学富集分析
应用非靶向代谢组学来鉴定肝细胞对SiNPs污染的代谢变化。OPLS-DA结果显示,所有QC样品都紧密聚集在一起,表明代谢组学分析具有良好的稳定性和可重复性(图5 A)。此外,图5 C中的OPLS-DA结果显示,中剂量组(25 μg/mL)与对照组的代谢谱差异显著。25 μg/mL SiNPs处理组鉴定到182个差异表达代谢物(Differentially Expressed Metabolites, DEMs)(图5 E)。分层聚类热图表明中剂量(25 μg/mL)SiNPs显著干扰了代谢物的表达(图5 F)。
基于KEGG数据库对DEMs代谢途径进行富集分析,结果显示,25 μg/mL SiNPs组显著富集的代谢途径包括抗坏血酸和醛酸盐代谢、丙氨酸、天冬氨酸和谷氨酸代谢、戊糖与葡萄糖酸盐的相互转化、糖酵解或糖异生和精氨酸生物合成(图6 A)。在这些代谢途径中富集了48种代谢物,聚类热图直观地显示了这48种代谢物的表达丰度(图6 B)。根据VIP值和差异倍数筛选了显著失调的代谢物,包括腺嘌呤、d -葡萄糖、l -丙氨酸、谷胱甘肽、三磷酸胞苷和三磷酸腺苷(图6 C)。综上所述,这些结果表明SiNPs引起L-02细胞代谢功能障碍。
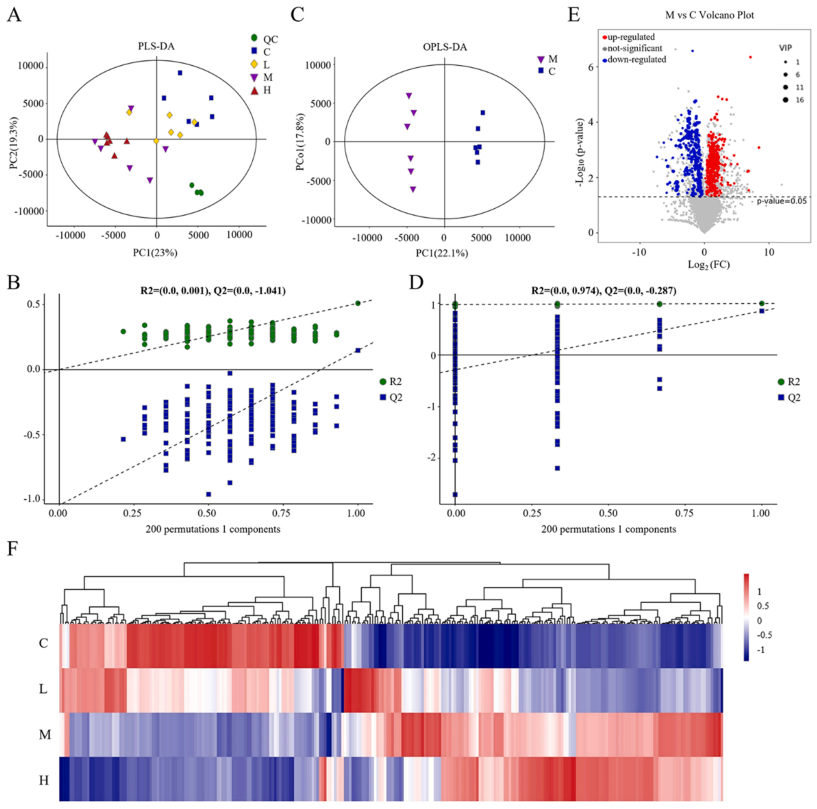
图5. SiNPs处理L-02细胞的代谢组学分析
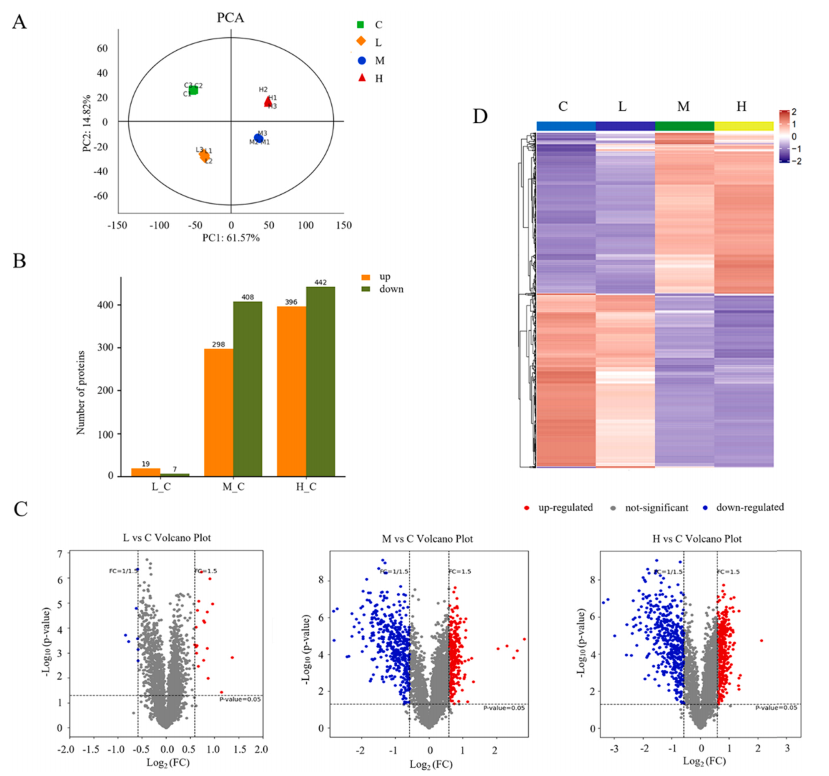
图6. 25 μg/mL SiNPs对L-02细胞代谢特性的影响
为了进一步探索SiNPs诱导肝毒性的潜在机制,研究人员对SiNPs处理的L-02肝细胞进行了蛋白质组学和代谢组学的联合分析。通路富集分析显示,SiNPs干扰了几个关键的代谢途径,包括葡萄糖代谢、氨基酸代谢和核糖核苷酸代谢(图7 A)。网络模型分析显示,显著差异的蛋白(TALDO1、ENO3、PGK1、ADSS、NME1、PGD和PGAM1)与代谢物(丙氨酸、天冬氨酸、谷氨酰胺、葡萄糖和三磷酸鸟苷)之间存在复杂的相互作用,可能导致SiNPs诱导的代谢功能障碍。(图7 B)。
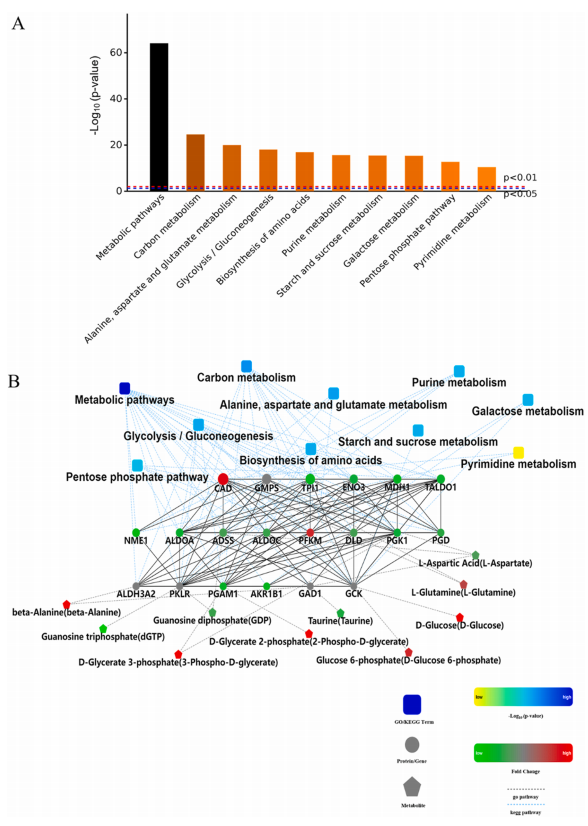
图7. 细胞暴露于25 μg/mL SiNPs后蛋白质组学和代谢组学的联合分析
基于蛋白质组学和代谢组学数据的联合分析,本研究使用qRT-PCR和Western Blot方法对SiNPs暴露后L-02细胞中的关键蛋白进行验证。通过对SiNPs处理后L-02细胞中GSH和GSSG的含量的测定,发现即使在低剂量组,GSH也明显下降,而GSSG却比未处理的细胞增加(图8 A和8 B)。蛋白质组学分析显示,暴露于25 μg/mL SiNPs后,SOD1蛋白水平显著降低(图8 C)。qRT-PCR同样证实了SOD1 mRNA水平的降低(图8 D)。SiNPs以剂量依赖性的方式刺激细胞内ROS的产生。根据蛋白质组学分析,SiNPs诱导糖代谢相关蛋白(PGM1、GPI、PGK1、PGD、TKT和TALDO1)、氨基酸代谢相关蛋白(GOT1、ADSL和ADSS2)和核糖核苷酸代谢相关蛋白(PNP、NME2和GDA)的表达水平显著降低(图8 E)。qRT-PCR结果证实,暴露于25 μg/mL SiNPs后,这些代谢相关蛋白的mRNA水平明显降低(图8 F)。为了验证这些结果,研究人员进行了Western Blot检测关键蛋白(TKT、PGM1、GOT1、PNP和NME2)的表达。发现这些蛋白在SiNPs处理的肝细胞中一致下调(图8 G)。
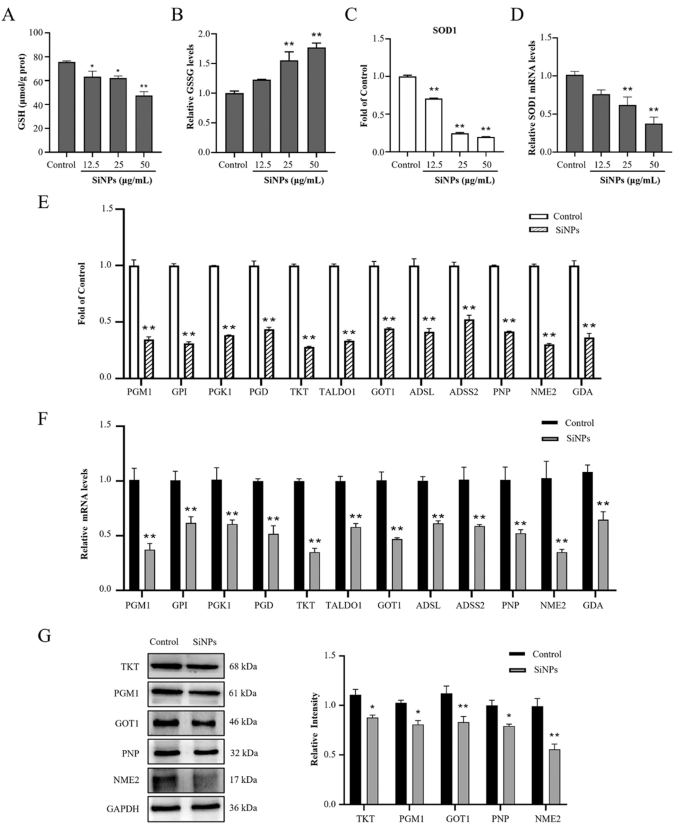
图8. 暴露于25 μg/mL SiNPs后差异丰度生物标志物的验证
本文综合蛋白质组学和代谢组学,研究SiNPs对肝细胞代谢谱的影响。首先,通过蛋白质组学分析筛选关键蛋白(包括RPL3、HSP90AA1、SOD、PGK1、GOT1和PNP),表明蛋白质合成异常、蛋白质错误折叠、氧化应激和代谢功能障碍可能与SiNPs诱导的肝毒性有关。代谢组学数据表明,SiNPs通过改变重要代谢物(包括葡萄糖、丙氨酸、谷胱甘肽、CTP和ATP)导致代谢功能障碍。最后,对蛋白质-代谢物相互作用的系统生物信息学分析表明,SiNPs干扰了葡萄糖代谢、氨基酸代谢和核糖核苷酸代谢。这些代谢功能障碍可能加剧氧化应激,导致肝损伤。此外,SOD、TKT、PGM1、GOT1、PNP和NME2可能是SiNPs诱导肝毒性的关键蛋白。本研究揭示了SiNPs诱导肝毒性的代谢机制,并表明整合组学分析可以成为纳米颗粒毒性评估和风险评估的有力方法。