
文章标题:Senescence Cell Induction Methods Display Diverse Metabolic Reprogramming and Reveal an Underpinning Serine/Taurine Reductive Metabolic Phenotype
发表期刊:Aging Cell
影响因子:7.1
研究背景
细胞水平生物分子损伤的全身积累是衰老核心,而衰老细胞表型以不可逆生长停滞为特征,伴随端粒缩短、DNA损伤、活性氧升高、线粒体功能障碍等标志。衰老细胞在组织中积累会破坏组织功能、引发神经退行性疾病、心血管疾病等,并通过细胞结构增大/硬化、自噬受损及分泌衰老相关分泌表型(SASP)等促进退行性变化。
现有多种体外方法研究衰老细胞生物分子变化,如检测p16/Rb、p21/p53、SA-β-Gal活性等;基于质谱的代谢物/蛋白质分析、稳定同位素示踪等技术,结合细胞变形性研究,在解析衰老相关分子失调、挖掘治疗靶点方面潜力巨大。
本研究开发多组学形态流变学平台,以HFF-1成纤维细胞为模型,通过复制传代、辐射、化学药物(羟基脲、依托泊苷)处理生成不同衰老诱导模型,后续分析整合代谢组学、蛋白组学及流变学数据,结合稳定同位素示踪,探究衰老相关代谢重编程方向。
研究结果
1.人成纤维细胞衰老诱导及衰老相关β-半乳糖苷酶表达
选用人成纤维(HFF-1)细胞,通过多次传代构建复制性衰老模型;同时用不同剂量X射线(引发DNA损伤)、羟基脲(抑制DNA合成)、依托泊苷(诱导DNA损伤)处理,构建应激诱导衰老模型。
以“细胞活力约50%、衰老相关β-半乳糖苷酶(SA-β-Gal)阳性细胞超50%”为标准优化模型后,确定后续分析参数:复制性衰老选用20代细胞,应激衰老分别选用12 Gy X射线照射、800 μM羟基脲、10 μM依托泊苷处理。优化后检测显示,20代细胞与羟基脲处理组SA-β-Gal阳性率约80%,辐射与依托泊苷处理组阳性率超60%,符合有效衰老模型标准。
2.衰老诱导表型的细胞变形能力与大小
为研究各方法诱导的细胞形态变化,该研究采用实时变形性流式细胞术(Real-Time Deformability Cytometry, RT-DC)测量细胞体积和变形能力(图 1)。微流控室设计可测量储液池中细胞初始形状及变形通道中的变形(图1A-B)。结果显示,与对照组相比,20代细胞、12 Gy照射、800 μM羟基脲、10 μM依托泊苷处理组细胞面积均显著更大(图1C)。其中早期传代(P3)与晚期传代(P20)细胞面积差异最显著;羟基脲处理组大小变异最小。所有测试条件在变形通道中变形能力均有显著差异;储液池中传代和照射组机械变形能力无显著差异,依托泊苷和羟基脲处理组有显著差异,表明不同衰老诱导方法会产生多种机械细胞表型。

图1. 实时变形性流式细胞术对不同衰老模型进行形态流变学分析
3.衰老相关的DNA损伤和细胞周期活性分子标志物
为明确各模型衰老的细胞内生物分子机制,研究分析20代细胞、12 Gy照射、800 μM羟基脲及10 μM依托泊苷处理细胞的分子标志物(γH2AX、Ki67、p21)。免疫定量分析显示(图2A):所有衰老诱导条件下,HFF-1细胞γH2AX灶(DNA双链断裂标志物)水平均升高,其中20代细胞与12 Gy照射组较对照组约增加300%,800 μM羟基脲与10 μM依托泊苷两种药物处理组则增加超500%;Ki67阳性细胞(细胞增殖标志物)中,20代、12 Gy照射及10 μM依托泊苷组较对照组显著降低,仅羟基脲组略增20%且该差异无统计学意义;p21阳性细胞(细胞周期调控蛋白)中,高传代和化学处理组增加10%-20%,其中 20代、12 Gy照射及10 μM依托泊苷组与对照组的差异显著,羟基脲组则无显著差异。
进一步分析表明,高传代、照射及依托泊苷处理细胞中,γH2AX灶表达增强与细胞周期阶段改变及增殖速率降低相关,而羟基脲处理细胞未表现出这种关联(图2B)。
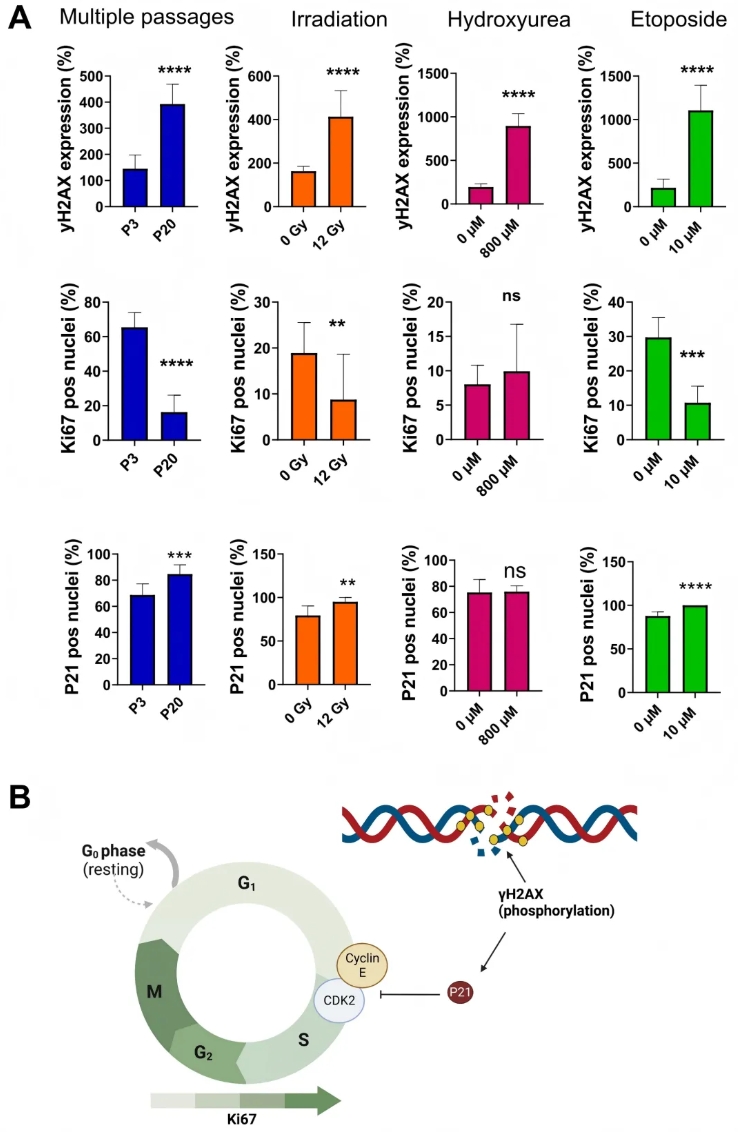
图2. 衰老诱导的正常HFF细胞中γH2AX、Ki-67及p21阳性细胞核的免疫检测
4.衰老诱导表型的代谢谱分析
为研究不同衰老模型的整体代谢变化,对经各种诱导处理的HFF-1细胞进行非靶标代谢组学分析。结果显示,所有处理组与对照组的代谢特征均明显分离(图3A)。其中,20代细胞中显著差异代谢物为天冬酰胺和柠檬酸,均呈下调趋势;照射处理细胞中为葡萄糖酸和邻苯二甲酸二(2-乙基己基)酯;羟基脲处理细胞中显著差异代谢物为O-乙酰肉碱;依托泊苷处理细胞中为3-甲基-2-氧代戊酸(图3B)。氨基酸是所有条件下变化最显著的类别,其中丝氨酸和牛磺酸失调最为突出——所有处理组中丝氨酸均上调,牛磺酸均下调;此外,脂质相关代谢物脱氧肉碱在所有处理组中也均呈下调趋势(图3C)。对细胞培养上清液(培养基)的代谢物分析显示,20代(高传代)和依托泊苷处理组苯丙氨酸下调,照射和羟基脲组则上调;20代、照射和依托泊苷组色氨酸水平较低,羟基脲组色氨酸升高。这表明氨基酸代谢失调在各种衰老诱导方法中高度保守,是衰老细胞共有的代谢特征之一。
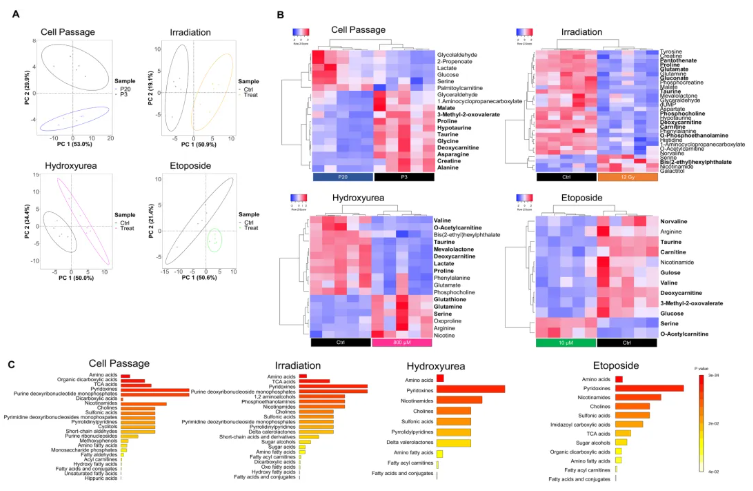
图3. 不同衰老诱导方法导致的代谢通路失调存在显著差异
5.衰老诱导表型的蛋白质组学分析
对经所有诱导方处理的HFF-1细胞进行蛋白质组学分析,同代谢组学分析类似,重点探究差异蛋白质表达水平及蛋白质功能分类。所有衰老诱导方法中,处理组与对照组的蛋白质表达特征均明显分离(图4A)。
热图显示,各组共同的显著差异蛋白质涉及多类功能,包括参与细胞器生物发生与运输(如TUBB、TUBB4B)、核膜重组(如RAN)、Rho GTPases信号传导(如CAVIN1),以及参与代谢过程(如ATP5F1A、ENO1)和免疫系统中细胞因子信号传导(如VIM、FSCN1)的蛋白质(图4B)。通路分析表明,所有条件下共有的显著通路为JAK–STAT通路(其相关介质蛋白已知可减弱细胞衰老和SASP)和白细胞介素12信号通路(其相关蛋白已知是SASP中的主要成分)。具体到各组,20代传代细胞无特异性富集的单独通路;照射处理细胞的差异蛋白质显著富集于细胞器生物发生相关通路;羟基脲处理细胞最显著的通路与细胞应激反应相关;依托泊苷处理细胞的注释蛋白质显著富集于NF-κB和Toll样受体信号通路。
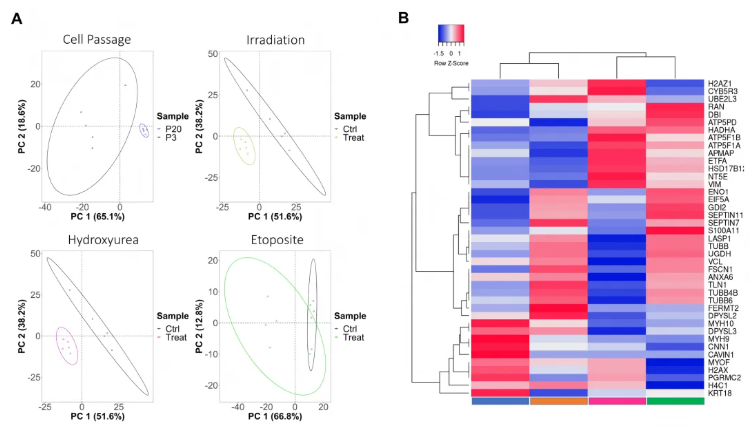
图4. 人包皮成纤维细胞(HFF-1)蛋白质特征的无标记蛋白质组学分析
6.多组学数据整合及已鉴定代谢途径的同位素示踪
为深入了解衰老诱导时的代谢途径变化,研究通过MetaboAnalyst软件开展联合通路分析,整合各测试条件(20代传代、12 Gy辐射、800 μM羟基脲、10 μM依托泊苷)下的重要蛋白质组学(关键酶表达)与代谢组学(代谢物水平)数据。结果显示,不同诱导方法富集的通路存在显著差异:传代和辐射处理细胞均涉及糖酵解通路,其中传代细胞还涉及戊糖磷酸途径,辐射细胞涉及苯丙氨酸代谢;羟基脲处理细胞显著富集谷胱甘肽代谢和精氨酸代谢;依托泊苷处理细胞以缬氨酸、亮氨酸等支链氨基酸代谢变化为特征。
同位素示踪分析(图5)进一步验证了衰老诱导后葡萄糖和谷氨酰胺的代谢流向差异:传代细胞中,¹³C-葡萄糖标记碳向柠檬酸的掺入量减少,而¹³C-谷氨酰胺标记碳向柠檬酸的掺入量增加,提示三羧酸循环中谷氨酰胺替代葡萄糖作为碳源供能;辐射和羟基脲处理细胞呈现类似趋势,均表现为¹³C-葡萄糖向柠檬酸掺入减少、¹³C-谷氨酰胺向柠檬酸掺入增加;依托泊苷处理细胞则无此碳掺入重排,即¹³C-葡萄糖与¹³C-谷氨酰胺向三羧酸循环关键代谢物的标记碳掺入均未出现显著调整。
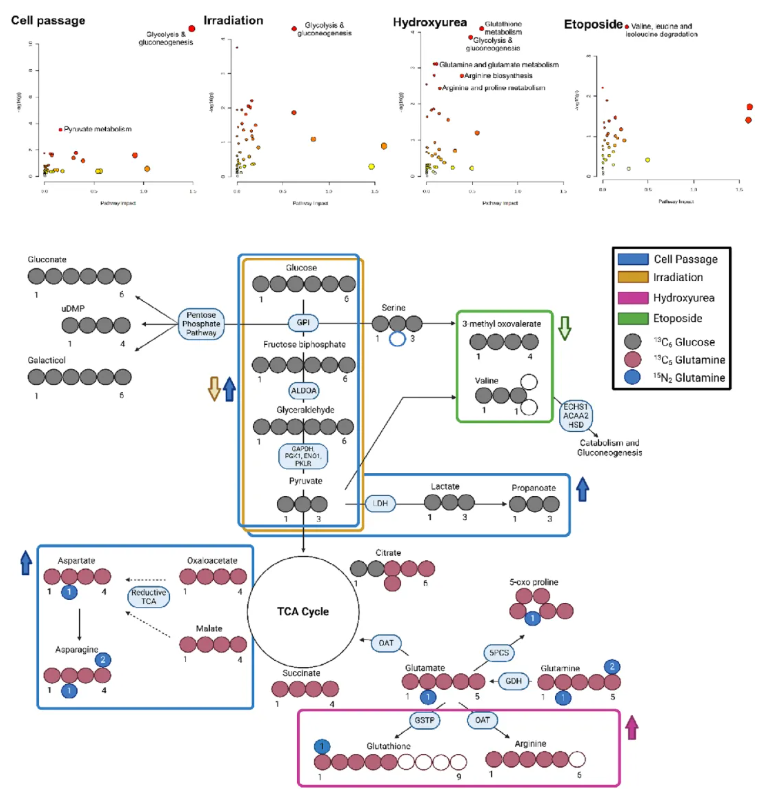
图5. 稳定同位素分析证实存在多种不同的代谢转换过程
研究小结
该研究通过整合实时变形性流式细胞术(RT-DC)、非靶标代谢组学、蛋白质组学及同位素示踪等多技术分析,明确不同衰老诱导方法(20代传代、12 Gy辐射、800 μM羟基脲、10 μM依托泊苷)会产生各异的细胞生物分子谱,显著影响细胞流变形态、代谢及蛋白质组,且不同诱导方法不可互换。所有诱导方法均存在代谢失调,衰老样细胞代谢倾向丝氨酸/牛磺酸还原途径,同时通过谷氨酰胺替代葡萄糖供能以减少氧化应激。但研究仅使用HFF-1细胞系,需进一步探究不同细胞系中结果的保守性;而记录的代谢物差异(如丝氨酸上调、牛磺酸下调等),可为开发针对代谢氧化还原回路(尤其是丝氨酸/牛磺酸代谢相关redox平衡)的抗衰老及相关疾病疗法提供依据。
非靶标代谢流:依托新一代代谢组学NGM 2的数据库、质控体系,背靠2W+代谢物标准品自建库,将代谢物的鉴定准确度提升至98.5%以上,并且极大地提升了同位素追踪的覆盖范围,能够在鉴定到上千种代谢物的同时进行稳定同位素标记的追踪。